मैक्सवेल-बोल्ट्ज़मैन आँकड़े
| Statistical mechanics |
|---|
 |

सांख्यिकीय यांत्रिकी में, मैक्सवेल-बोल्ट्ज़मैन आँकड़े ऊष्मीय संतुलन में विभिन्न ऊर्जा अवस्थाओं पर शास्त्रीय भौतिकी पदार्थ कणों के वितरण का वर्णन करते हैं। यह तब लागू होता है जब तापमान अत्यधिक अधिक होता है या कण घनत्व इतना कम होता है कि क्वांटम प्रभाव नगण्य हो जाता है।
इस प्रकार से मैक्सवेल-बोल्ट्ज़मैन आँकड़ों के लिए ऊर्जा वाले कणों की अपेक्षित संख्या
है, जहां:
- i-वें ऊर्जा स्तर की ऊर्जा है,
- ऊर्जा वाले अवस्थाओं के समुच्चय में कणों की औसत संख्या है,
- ऊर्जा स्तर i का अपक्षयी ऊर्जा स्तर है, अर्थात, ऊर्जा वाले अवस्थाओं की संख्या जिन्हें फिर भी किसी अन्य माध्यम से दूसरे से अलग किया जा सकता है,[nb 1]
- μ रासायनिक क्षमता है,
- k बोल्ट्ज़मैन स्थिरांक है,
- T पूर्ण तापमान है,
- N कणों की कुल संख्या है:
- Z विभाजन फलन (सांख्यिकीय यांत्रिकी) है:
- e, E (गणितीय स्थिरांक) या यूलर की संख्या है
समान रूप से, कणों की संख्या को कभी-कभी
के रूप में व्यक्त किया जाता है, जहां सूचकांक अब ऊर्जा , और वाले सभी अवस्थाओं के समुच्चय के अतिरिक्त एक विशेष अवस्था को निर्दिष्ट करता है।
इतिहास
अतः मैक्सवेल-बोल्ट्ज़मैन आँकड़े मैक्सवेल-बोल्ट्ज़मैन वितरण से विकसित हुए, संभवतः अंतर्निहित तकनीक के आसवन के रूप में है। इस प्रकार से वितरण प्रथतमतः मैक्सवेल द्वारा 1860 में अनुमान के आधार पर निकाला गया था। बोल्ट्ज़मैन ने बाद में, 1870 के दशक में, इस वितरण की भौतिक उत्पत्ति की महत्वपूर्ण जांच की थी। वितरण इस आधार पर प्राप्त किया जा सकता है कि यह निकाय की एन्ट्रापी को अधिकतम करता है।
प्रयोज्यता
अतः मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी का उपयोग किसी आदर्श गैस के मैक्सवेल-बोल्ट्ज़मैन वितरण को प्राप्त करने के लिए किया जाता है। यद्यपि, इसका उपयोग उस वितरण को भिन्न ऊर्जा-संवेग संबंध वाले कणों तक विस्तारित करने के लिए भी किया जा सकता है, जैसे कि सापेक्ष कण (जिसके परिणामस्वरूप मैक्सवेल-जुटनर वितरण होता है), और त्रि-आयामी स्थानों के अतिरिक्त अन्य।
इस प्रकार से मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी को प्रायः विशिष्ट शास्त्रीय कणों के आंकड़ों के रूप में वर्णित किया जाता है। दूसरे शब्दों में, अवस्था 1 में कण A और अवस्था 2 में कण B का विन्यास उस स्थिति से भिन्न है जिसमें कण B अवस्था 1 में है और कण A अवस्था 2 में है। यह धारणा उचित (बोल्ट्ज़मैन) आँकड़ों की ओर ले जाती है ऊर्जा अवस्थाओं में कण, परंतु एन्ट्रापी के लिए गैर-भौतिक परिणाम देते हैं, जैसा कि गिब्स विरोधाभास में सन्निहित है।
साथ ही, ऐसे कोई वास्तविक कण नहीं हैं जिनमें मैक्सवेल-बोल्ट्ज़मैन सांख्यिकी के लिए आवश्यक विशेषताएं हों। वस्तुतः, गिब्स विरोधाभास हल हो जाता है यदि हम निश्चित प्रकार के सभी कणों (जैसे, इलेक्ट्रॉन, प्रोटॉन, आदि) को मुख्य रूप से अप्रभेद्य मानते हैं। एक बार जब यह धारणा बन जाती है, तो कण आँकड़े बदल जाते हैं। इसी प्रकार से मिश्रण उदाहरण की एन्ट्रापी में परिवर्तन को दो प्रकार के मिश्रित कणों की भिन्नता के परिणामस्वरूप होने वाली गैर-व्यापक एन्ट्रापी के उदाहरण के रूप में देखा जा सकता है।
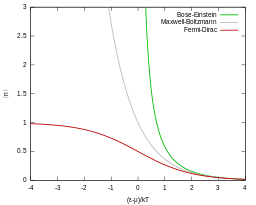
अतः क्वांटम कण या तो बोसोन (बोस-आइंस्टीन आंकड़ों के अनुसार) या फर्मियन (पाउली अपवर्जन सिद्धांत के अंतर्गत, इसके अतिरिक्त फर्मी-डिराक आंकड़ों) हैं। ये दोनों क्वांटम आँकड़े उच्च तापमान और कम कण घनत्व की सीमा में मैक्सवेल-बोल्ट्ज़मैन आँकड़ों के निकट पहुँचते हैं।
व्युत्पत्तियाँ
इस प्रकार से मैक्सवेल-बोल्ट्ज़मैन आँकड़े विभिन्न सांख्यिकीय यांत्रिकी ऊष्मागतिक समूहों में प्राप्त किए जा सकते हैं:[1]
- निश्चित भव्य विहित समुच्चय।
- विहित समुच्चय, निश्चित।
- सूक्ष्मविहित समुच्चय, परंतु मात्र ऊष्मागतिक सीमा में।
अतः प्रत्येक स्थिति में यह मानना आवश्यक है कि कण गैर-अंतःक्रिया कर रहे हैं, और कई कण ही स्थिति में रह सकते हैं और स्वतंत्र रूप से ऐसा कर सकते हैं।
सूक्ष्मविहित समुच्चय से व्युत्पत्ति
मान लीजिए कि हमारे निकट पात्र है जिसमें समान भौतिक विशेषताओं (जैसे द्रव्यमान, आवेश, आदि) वाले बहुत छोटे कणों की बड़ी संख्या है। आइए इसे निकाय के रूप में देखें। अतः मान लें कि यद्यपि कणों के गुण समान हैं, फिर भी वे भिन्न हैं। इस प्रकार से उदाहरण के लिए, हम प्रत्येक कण की पहचान उनके प्रक्षेपपथों को निरंतर देखकर, या प्रत्येक पर चिन्ह लगाकर कर सकते हैं, उदाहरण के लिए, प्रत्येक पर अलग संख्या खींचना, जैसा कि प्रचयन गेंदों के साथ किया जाता है।
अतः कण उस पात्र के भीतर सभी दिशाओं में बड़ी तीव्रता से घूम रहे हैं। क्योंकि कण तीव्रता से घूम रहे हैं, उनमें कुछ ऊर्जा होती है। मैक्सवेल-बोल्ट्ज़मैन वितरण गणितीय फलन है जो बताता है कि पात्र में कितने कणों में निश्चित ऊर्जा है। अधिक यथार्थ रूप से, मैक्सवेल-बोल्ट्ज़मान वितरण गैर-सामान्यीकृत संभाव्यता देता है (इसका अर्थ है कि संभावनाएं 1 तक नहीं जुड़ती हैं) कि विशेष ऊर्जा के अनुरूप अवस्था पर अधिकृत कर लिया गया है।
सामान्यतः, समान मात्रा में ऊर्जा वाले कई कण हो सकते हैं। मान लीजिए समान ऊर्जा वाले कणों की संख्या है, अन्य ऊर्जा वाले कणों की संख्या है, और इसी प्रकार सभी संभावित ऊर्जाओं के लिए है। इस स्थिति का वर्णन करने के लिए, हम कहते हैं कि ऊर्जा स्तर की अधिष्ठान संख्या है। यदि हमें सभी अधिष्ठान संख्याएँ ज्ञात हैं, तब हमें निकाय की कुल ऊर्जा ज्ञात होती है। यद्यपि, क्योंकि हम यह अंतर कर सकते हैं कि कौन से कण प्रत्येक ऊर्जा स्तर पर अधिकृत कर रहे हैं, अधिष्ठान संख्याओं का समुच्चय निकाय की स्थिति का पूर्ण रूप से वर्णन नहीं करता है। निकाय की स्थिति, या सूक्ष्म अवस्था का पूर्ण रूप से वर्णन करने के लिए, हमें यह निर्दिष्ट करना होगा कि प्रत्येक ऊर्जा स्तर में कौन से कण हैं। इस प्रकार जब हम निकाय के संभावित अवस्थाओं की संख्या की गणना करते हैं, तो हमें प्रत्येक सूक्ष्म अवस्था की गणना करनी चाहिए, न कि मात्रअधिष्ठान संख्याओं के संभावित समुच्चयों की।
आरंभ करने के लिए, मान लें कि प्रत्येक ऊर्जा स्तर पर मात्र एक ही अवस्था (कोई पतन नहीं है) है। इसके पश्चात जो कुछ होता है वह कुछ संयुक्त सोच है जिसका कणों के भंडार का यथार्थ वर्णन करने में बहुत कम योगदान है। उदाहरण के लिए, मान लें कि लेबल वाले कुल बक्से हैं। संयोजन की अवधारणा के साथ, हम गणना कर सकते हैं कि बक्से के समूह में को व्यवस्थित करने के कितनी विधियाँ हैं, जहां प्रत्येक बक्से के भीतर गेंदों के क्रम को ट्रैक नहीं किया जाता है। सर्वप्रथम, हम कुल गेंदों में से गेंदों को बक्से , में रखने के लिए चुनते हैं, और शेष गेंदों में से प्रत्येक बक्से के लिए चयन करना जारी रखते हैं, यह सुनिश्चित करते हुए कि प्रत्येक गेंद को किसी एक बक्से में रखा जाता है। गेंदों को व्यवस्थित करने की विधियों की कुल संख्या
है। चूँकि प्रत्येक गेंद को एक बक्से में रखा गया है, , और हम अभिव्यक्ति को
- के रूप में सरल बनाते हैं।
यह मात्र बहुपद गुणांक है, N वस्तुओं को k बक्से में व्यवस्थित करने की विधियों की संख्या, l-वें बक्से में Nl वस्तु हैं, प्रत्येक बक्से में वस्तु के क्रमपरिवर्तन को अनदेखा किया गया है।
अब, उस स्थिति पर विचार करें जहां बक्से में कणों को रखने की एक से अधिक विधि है (अर्थात अपक्षय समस्या को ध्यान में रखते हुए)। यदि -वें बक्से में की "अक्षमता" है, अर्थात इसमें समान ऊर्जा वाले उप-बक्से ( बक्से हैं। समान ऊर्जा वाली इन अवस्थाओं/बक्सों को पतित अवस्थाएँ कहा जाता है।), जैसे कि -वें बक्से को भरने की कोई भी विधि जहां उप-बक्सों में संख्या बदल जाती है, बक्से को भरने की एक अलग विधि है, फिर यह की संख्या i-वें बक्से को भरने के तरीकों को उप-बक्से में वस्तुओं को वितरित करने की विधियों की संख्या से बढ़ाया जाना चाहिए। अलग-अलग वस्तुओं को उप-बक्से में रखने की विधि की संख्या है (प्रथम वस्तु किसी भी बक्से में जा सकती है, दूसरी वस्तु किसी भी बक्से में जा सकता है, इत्यादि)। अतः इस प्रकार विधियों की संख्या जिससे कुल कणों को उनकी ऊर्जा के अनुसार ऊर्जा स्तरों में वर्गीकृत किया जा सकता है, जबकि प्रत्येक स्तर में अलग-अलग स्थितियाँ होती हैं जैसे कि i-वें स्तर कणों को समायोजित करता है:
यह W का वह रूप है जिसे सर्वप्रथम लुडविग बोल्ट्ज़मान ने व्युत्पन्न किया था। बोल्ट्ज़मैन का मौलिक समीकरण ऊष्मागतिक एन्ट्रॉपी S को सूक्ष्म अवस्था W की संख्या से संबंधित करता है, जहां k बोल्ट्जमैन स्थिरांक है। यद्यपि, जोशिया विलार्ड गिब्स द्वारा यह बताया गया था कि W के लिए उपरोक्त अभिव्यक्ति व्यापक मात्रा में एन्ट्रापी उत्पन्न नहीं करती है, और इसलिए दोषपूर्ण है। इस समस्या को गिब्स विरोधाभास के नाम से जाना जाता है। समस्या यह है कि उपरोक्त समीकरण द्वारा माने गए कण समान कण नहीं हैं। दूसरे शब्दों में, दो ऊर्जा उपस्तरों में दो कणों (A और B) के लिए [A, B] द्वारा दर्शाई गई जनसंख्या को जनसंख्या [B, A] से अलग माना जाता है, जबकि अविभाज्य कणों के लिए, वे नहीं हैं। यदि हम अविभाज्य कणों के लिए तर्क को आगे बढ़ाते हैं, तो हम W के लिए बोस-आइंस्टीन अभिव्यक्ति की ओर ले जाते हैं:
मैक्सवेल-बोल्ट्ज़मैन वितरण पूर्ण शून्य से ऊपर के तापमान के लिए इस बोस-आइंस्टीन वितरण का अनुसरण करता है, जिसका अर्थ है कि । मैक्सवेल-बोल्ट्ज़मैन वितरण को भी कम घनत्व की आवश्यकता होती है, जिसका अर्थ है कि । अतः इन प्रतिबंधों के अंतर्गत, हम क्रमगुणित के लिए स्टर्लिंग सन्निकटन का उपयोग कर सकते हैं:
लिखने के लिए:
इस तथ्य का उपयोग करते हुए कि के लिए हम फिर से लिखने के लिए स्टर्लिंग के सन्निकटन का उपयोग कर सकते हैं:
यह मूलतः N! द्वारा विभाजन है, जों W के लिए बोल्ट्ज़मैन की मूल अभिव्यक्ति, और इस संशोधन को उचित कहा जाता है
हम को खोजना चाहते हैं जिसके लिए फलन को अधिकतम किया गया है, जबकि इस बाधा पर विचार करते हुए कि पात्र में कणों की एक निश्चित संख्या और एक निश्चित ऊर्जा है। और की अधिकतम सीमा के समान मानों द्वारा प्राप्त की जाती है और, चूंकि गणितीय रूप से इसे पूर्ण करना सरल है, हम इसके अतिरिक्त बाद वाले फलन को अधिकतम करेंगे। हम फलन बनाने वाले लैग्रेंज गुणक का उपयोग करके अपने हल को बाधित करते हैं:
अंत में
अतः उपरोक्त अभिव्यक्ति को अधिकतम करने के लिए हम फ़र्मेट के प्रमेय (स्थिर बिंदु) को लागू करते हैं, जिसके अनुसार स्थानीय एक्स्ट्रेमा, यदि स्थित है, तो महत्वपूर्ण बिंदुओं पर होना चाहिए (आंशिक व्युत्पन्न लुप्त हो जाते हैं):
() से ऊपर के समीकरणों को हल करके हम के लिए एक अभिव्यक्ति पर पहुंचते हैं:
के लिए इस अभिव्यक्ति को के समीकरण में प्रतिस्थापित करने और यह मानने पर कि प्राप्त होता है:
या, पुनर्व्यवस्थित करते हुए:
अतः बोल्ट्ज़मैन ने समझा कि यह ऊष्मागतिक के यूलर-एकीकृत मौलिक समीकरण की अभिव्यक्ति मात्र है। इस प्रकार से E को आंतरिक ऊर्जा के रूप में पहचानते हुए, यूलर-एकीकृत मौलिक समीकरण बताता है कि:
जहां T तापमान है, P दाब है, V आयतन है, और μ रासायनिक क्षमता है। बोल्ट्ज़मैन का प्रसिद्ध समीकरण यह समझा है कि एन्ट्रापी के समानुपाती होती है और आनुपातिकता का स्थिरांक बोल्ट्जमैन स्थिरांक होता है। अतः इस अवस्था के आदर्श गैस समीकरण (PV=NkT) का उपयोग करते हुए, यह तुरंत और का अनुसरण करता है ताकि संख्या अब लिखी जा सके:
ध्यान दें कि उपरोक्त सूत्र कभी-कभी लिखा जाता है:
जहां पूर्ण गतिविधि (रसायन विज्ञान) है।
वैकल्पिक रूप से, हम जनसंख्या संख्याओं को
के रूप में प्राप्त करने के लिए इस तथ्य का उपयोग कर सकते हैं कि
जहां Z द्वारा परिभाषित विभाजन फलन (सांख्यिकीय यांत्रिकी) है:
एक सन्निकटन में जहां εi को एक सतत चर माना जाता है, थॉमस-फर्मी सन्निकटन एक सतत अध:पतन g उत्पन्न करता है जो के समानुपाती होता है ताकि:
जो ऊर्जा के लिए मात्र मैक्सवेल-बोल्ट्ज़मैन वितरण है।
विहित समुच्चय से व्युत्पत्ति
अतः उपरोक्त चर्चा में, निकाय की बहुलताओं का प्रत्यक्ष विश्लेषण करके बोल्ट्ज़मैन वितरण फलन प्राप्त किया गया था। वैकल्पिक रूप से, कोई विहित समुच्चय का उपयोग कर सकता है। इस प्रकार से विहित समूह में, निकाय भंडार के साथ ऊष्मीय संपर्क में है। जबकि ऊर्जा निकाय और भंडार के बीच प्रवाहित होने के लिए स्वतंत्र है, माना जाता है कि संयुक्त प्रणाली के लिए निरंतर तापमान, T बनाए रखने के लिए भंडार में अनंततः बड़ी ताप क्षमता होती है।
वर्तमान संदर्भ में, हमारी प्रणाली में ऊर्जा स्तर के साथ अध:पतन माना जाता है। पहले के जैसे, हम इस संभावना की गणना करना चाहेंगे कि हमारे निकाय में ऊर्जा है।
यदि हमारा निकाय अवस्था में है, तो भंडार के लिए समान संख्या में सूक्ष्म अवस्था उपलब्ध होंगे। इस संख्या से संपर्क करें। इस प्रकार से धारणा के अनुसार, संयुक्त प्रणाली (जिस प्रणाली में हम रुचि रखते हैं और भंडार) पृथक है, इसलिए सभी सूक्ष्म अवस्था समान रूप से संभावित हैं। इसलिए, उदाहरण के लिए, यदि, तो हम यह निष्कर्ष निकाल सकते हैं कि हमारा निकाय की तुलना में स्थिति में होने की दोगुनी संभावना है। सामान्यतः, यदि संभावना है कि हमारा निकाय ,
- स्थिति में है।
चूंकि भंडार की एन्ट्रापी , उपरोक्त
- हो जाती है।
आगे हम ऊष्मागतिक सर्वसमिका (ऊष्मागतिकी के प्रथम नियम से) को याद करते हैं:
- ।
अतः एक विहित समूह में, कणों का कोई आदान-प्रदान नहीं होता है, इसलिए पद शून्य है। इसी प्रकार, । यह
देता है, जहां और क्रमशः पर भंडार और निकाय की ऊर्जा को दर्शाते हैं। दूसरी समानता के लिए हमने ऊर्जा संरक्षण का प्रयोग किया है। :
से संबंधित पहले समीकरण में प्रतिस्थापित करने से तात्पर्य है, निकाय
के किसी भी अवस्था s 1 के लिए जहां Z कुल संभावना 1 बनाने के लिए उचित रूप से चुना गया "स्थिर" है। (Z स्थिरांक है यद्यपि यह कि तापमान T अपरिवर्तनीय हो।)
जहां सूचकांक s निकाय के सभी सूक्ष्म अवस्था से होकर गुजरता है। अतः Z को कभी-कभी बोल्ट्ज़मैन 'सम ओवर स्टेट्स' (या मूल जर्मन में ज़ुस्टैंड्ससुमे) कहा जाता है। यदि हम सभी संभावित अवस्थाओं के अतिरिक्त ऊर्जा आइगेनमानों के माध्यम से योग को अनुक्रमित करते हैं, तो अध: पतन को ध्यान में रखा जाना चाहिए। हमारे निकाय में ऊर्जा होने की संभावना मात्र सभी संबंधित सूक्ष्म अवस्थाओं की संभावनाओं का योग है:
जहां, स्पष्ट संशोधन के साथ,
यह पूर्व जैसा ही परिणाम है।
इस व्युत्पत्ति पर टिप्पणियाँ:
- ध्यान दें कि इस सूत्रीकरण में, प्रारंभिक धारणा... मान लीजिए कि निकाय में कुल N कण हैं... जिनको समाप्त कर दिया गया है। वस्तुतः, निकाय में स्थित कणों की संख्या वितरण पर पहुंचने में कोई भूमिका नहीं निभाती है। जबकि, कितने कण ऊर्जा वाले अवस्थाओं पर अधिकृत करेंगे एक सरल परिणाम के रूप में अनुसरण करता है।
- ऊपर जो प्रस्तुत किया गया है वह मूलतः विहित विभाजन फलन की व्युत्पत्ति है। जैसा कि कोई परिभाषाओं की तुलना करके देख सकता है, अवस्थाओं पर बोल्ट्ज़मैन का योग विहित विभाजन फलन के बराबर है।
- निश्चित उसी दृष्टिकोण का उपयोग फर्मी-डिरैक और बोस-आइंस्टीन सांख्यिकी प्राप्त करने के लिए किया जा सकता है। यद्यपि, वहाँ कोई विहित समुच्चय को भव्य विहित समुच्चय से बदल देगा, क्योंकि निकाय और भंडार के बीच कणों का आदान-प्रदान होता है। साथ ही, उन स्थितियों में जिस प्रणाली पर विचार किया जाता है वह एकल कण अवस्था है, कण नहीं। (उपरोक्त चर्चा में, हम अपने निकाय को एकल परमाणु मान सकते थे।)
यह भी देखें
- बोस-आइंस्टीन आँकड़े
- फ़र्मी-डिरैक आँकड़े
- बोल्ट्ज़मान कारक
टिप्पणियाँ
- ↑ For example, two simple point particles may have the same energy, but different momentum vectors. They may be distinguished from each other on this basis, and the degeneracy will be the number of possible ways that they can be so distinguished.
संदर्भ
- ↑ Tolman, R. C. (1938). सांख्यिकीय यांत्रिकी के सिद्धांत. Dover Publications. ISBN 9780486638966.
ग्रन्थसूची
- कार्टर, एशले एच., "क्लासिकल एंड स्टैटिस्टिकल थर्मोडायनामिक्स", प्रेंटिस-हॉल, इंक., 2001, न्यू जर्सी।
- राज पथरिया, "सांख्यिकीय यांत्रिकी", बटरवर्थ-हेनमैन, 1996।