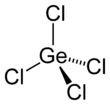
जर्मेनियम टेट्राक्लोराइड

| |||
|
| |||
| Names | |||
|---|---|---|---|
| IUPAC names
Germanium tetrachloride
Tetrachlorogermane Tetrachloridogermanium | |||
| Other names
Germanium(IV) chloride
Neutral germanium chloride (1:4) | |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
PubChem CID
|
|||
| RTECS number |
| ||
| UNII | |||
| |||
| |||
| Properties | |||
| GeCl4 | |||
| Molar mass | 214.40 g/mol | ||
| Appearance | Colourless liquid | ||
| Density | 1.879 g/cm3 (20 °C) 1.844 g/cm3 (30 °C)[1] | ||
| Melting point | −49.5 °C (−57.1 °F; 223.7 K) | ||
| Boiling point | 86.5 °C (187.7 °F; 359.6 K) | ||
| Soluble, hydrolyses | |||
| Solubility | Soluble in ether, benzene, chloroform, CCl4 Very soluble in HCl, dilute H2SO4 | ||
| −72.0·10−6 cm3/mol | |||
Refractive index (nD)
|
1.464 | ||
| Structure | |||
| tetrahedral[2] | |||
| Thermochemistry[3] | |||
Std molar
entropy (S |
245.6 J·mol−1·K−1 | ||
Std enthalpy of
formation (ΔfH⦵298) |
−531.8 kJ·mol−1 | ||
Gibbs free energy (ΔfG˚)
|
−462.7 kJ·mol−1 | ||
| Hazards | |||
| Occupational safety and health (OHS/OSH): | |||
Main hazards
|
Reacts slowly with water to form HCl and GeO2, corrosive, lachrymator | ||
| NFPA 704 (fire diamond) | |||
| Flash point | Non-flammable | ||
| Safety data sheet (SDS) | "External MSDS" | ||
| Related compounds | |||
Other anions
|
Germanium tetrafluoride Germanium tetrabromide Germanium tetraiodide | ||
Other cations
|
Carbon tetrachloride Silicon tetrachloride Tin(IV) chloride Lead(IV) chloride | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
जर्मेनियम टेट्राक्लोराइड एक रंगहीन, धुआँदार तरल है[4] एक अजीब, अम्लीय गंध के साथ. इसका उपयोग शुद्ध जर्मेनियम धातु के उत्पादन में मध्यवर्ती के रूप में किया जाता है। हाल के वर्षों में, GeCl4 प्रकाशित तंतु उत्पादन के लिए अभिकर्मक के रूप में इसके उपयोग के कारण इसका उपयोग काफी हद तक बढ़ गया है।
उत्पादन
जर्मेनियम का अधिकांश व्यावसायिक उत्पादन जस्ता और तांबा-अयस्क स्मेल्टरों की ग्रिप-धूल के उपचार से होता है, हालांकि खिड़की नामक कुछ प्रकार के कोयले के दहन से राख में एक महत्वपूर्ण स्रोत भी पाया जाता है। जर्मेनियम टेट्राक्लोराइड जर्मेनियम धातु या उसके ऑक्साइड, GeO के शुद्धिकरण के लिए एक मध्यवर्ती है2.[5] जर्मेनियम टेट्राक्लोराइड सीधे GeO से उत्पन्न किया जा सकता है2 (जर्मेनियम डाइऑक्साइड) सांद्र हाइड्रोक्लोरिक एसिड में ऑक्साइड के विघटन से। परिणामी मिश्रण को जर्मेनियम टेट्राक्लोराइड को अन्य उत्पादों और अशुद्धियों से शुद्ध करने और अलग करने के लिए आंशिक रूप से आसुत किया जाता है।[6] GeCl4 शुद्ध GeO उत्पन्न करने के लिए इसे विआयनीकृत जल से जल अपघटित किया जा सकता है2, जिसे फिर जर्मेनियम धातु का उत्पादन करने के लिए हाइड्रोजन के तहत कम किया जाता है।[5][6]
GeO का उत्पादन2हालाँकि, यह अयस्क से निकाले गए जर्मेनियम के ऑक्सीकृत रूप पर निर्भर है। कॉपर-सीसा-सल्फाइड और जिंक-सल्फाइड अयस्क जर्मेनियम डाइसल्फ़ाइड|GeS का उत्पादन करेंगे2, जो बाद में GeO में ऑक्सीकृत हो जाता है2 सोडियम क्लोरेट जैसे ऑक्सीडाइज़र के साथ। जिंक-अयस्कों को भुना और सिंटर किया जाता है और GeO का उत्पादन किया जा सकता है2 सीधे. फिर ऊपर चर्चा के अनुसार ऑक्साइड को संसाधित किया जाता है।[5]
ऊंचे तापमान पर क्लोरीन और जर्मेनियम धातु से क्लासिक संश्लेषण भी संभव है।[7][1]इसके अतिरिक्त, एक क्लोरीन मुक्त जर्मेनियम प्रसंस्करण विकसित किया गया है, जो जर्मेनियम अग्रदूतों के लिए कम ऊर्जा गहन और अधिक पर्यावरण अनुकूल वैकल्पिक संश्लेषण प्रदान करता है।
आवेदन
जर्मेनियम टेट्राक्लोराइड का उपयोग लगभग विशेष रूप से कई ऑप्टिकल प्रक्रियाओं के लिए एक मध्यवर्ती के रूप में किया जाता है। GeCl4 सीधे GeO में जल अपघटित किया जा सकता है2, कई अद्वितीय गुणों और अनुप्रयोगों वाला एक ऑक्साइड ग्लास, जिसका वर्णन नीचे और लिंक किए गए लेखों में किया गया है:
फाइबर ऑप्टिक्स
GeCl का एक उल्लेखनीय व्युत्पन्न4 जर्मेनियम डाइऑक्साइड है. प्रकाशित रेशे के निर्माण में, सिलिकॉन टेट्राक्लोराइड, SiCl4, और जर्मेनियम टेट्राक्लोराइड, GeCl4, ऑक्सीजन के साथ एक खोखले ग्लास प्रीफॉर्म में पेश किया जाता है, जिसे अभिकर्मकों के ऑक्सीकरण को उनके संबंधित ऑक्साइड और ग्लास मिश्रण के गठन की अनुमति देने के लिए सावधानीपूर्वक गर्म किया जाता है। जियो2 इसमें अपवर्तन का उच्च सूचकांक होता है, इसलिए जर्मेनियम टेट्राक्लोराइड की प्रवाह दर को अलग-अलग करके ऑप्टिकल फाइबर के समग्र अपवर्तक सूचकांक को विशेष रूप से नियंत्रित किया जा सकता है। जियो2 कांच के वजन के हिसाब से लगभग 4% है।[5]
संदर्भ
- ↑ 1.0 1.1 P.W. Schenk (1963). "Germanium(IV) Chloride". In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 1. NY,NY: Academic Press. pp. 715–716.
- ↑ Merz, K.; Driess, M. (2002). "Germanium(IV) chloride at 193 K". Acta Crystallogr. C. 58 (Pt 7): i101–i102. doi:10.1107/S0108270102010351. PMID 12094027.
- ↑ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 377. ISBN 978-0-08-037941-8.
- ↑ 5.0 5.1 5.2 5.3 "Germanium" Mineral Commodity Profile, U.S. Geological Survey, 2005.
- ↑ 6.0 6.1 "The Elements" C. R. Hammond, David R. Lide, ed. CRC Handbook of Chemistry and Physics, Edition 85 (CRC Press, Boca Raton, Florida) (2004)
- ↑ "GeCl4 synthesis". account.e.jimdo.com. Technische Universitä Ilmenau. Retrieved 2020-09-22.
{{cite web}}: CS1 maint: url-status (link)
यह भी देखें
- जर्मेनियम
- प्रकाशित तंतु
- अवरक्त
श्रेणी:जर्मेनियम(IV) यौगिक श्रेणी:क्लोराइड श्रेणी:धातु हैलाइड्स श्रेणी: अधातु हैलाइड
- CS1 maint: others
- Articles without EBI source
- Articles without KEGG source
- Pages using collapsible list with both background and text-align in titlestyle
- Articles containing unverified chemical infoboxes
- Templates that generate short descriptions
- Collapse templates
- Navigational boxes
- Navigational boxes without horizontal lists
- Sidebars with styles needing conversion
- Templates generating microformats
- Templates that are not mobile friendly
- Wikipedia metatemplates
- Machine Translated Page
- Created On 03/08/2023