रासायनिक संयोजन इलेक्ट्रॉन
रसायन विज्ञान और भौतिकी में, एक वैलेंस इलेक्ट्रॉन एक परमाणु से जुड़े बाहरी इलेक्ट्रॉन खोल में एक इलेक्ट्रॉन होता है, और यदि बाहरी खोल बंद नहीं होता है तो वह रासायनिक बंधन के निर्माण में भाग ले सकता है। एक सहसंयोजक बंधन में, बंधन में दोनों परमाणु एक साझा जोड़ी बनाने के लिए एक वैलेंस इलेक्ट्रॉन का योगदान करते हैं।
वैलेंस इलेक्ट्रॉनों की उपस्थिति रासायनिक तत्व के रसायन गुणों को निर्धारित कर सकती है, जैसे कि इसकी वैलेंस (रसायन विज्ञान) - क्या यह अन्य तत्वों के साथ बंध सकता है और यदि हां, तो कितनी आसानी से और कितने के साथ। इस तरह, किसी दिए गए तत्व की प्रतिक्रियाशीलता (रसायन विज्ञान) उसके इलेक्ट्रॉन विन्यास पर अत्यधिक निर्भर है। एक मुख्य-समूह तत्व के लिए, एक संयोजी इलेक्ट्रॉन केवल सबसे बाहरी इलेक्ट्रॉन खोल में मौजूद हो सकता है; एक संक्रमण धातु के लिए, एक संयोजी इलेक्ट्रॉन एक आंतरिक खोल में भी हो सकता है।
वैलेंस इलेक्ट्रॉनों के एक बंद खोल के साथ एक परमाणु (एक महान गैस विन्यास के अनुरूप) अक्रिय गैसों की ओर जाता है। सकारात्मक आयन बनाने के लिए अतिरिक्त वैलेंस इलेक्ट्रॉनों को हटाने के लिए अपेक्षाकृत आयनीकरण ऊर्जा के कारण एक बंद शेल से अधिक एक या दो वैलेंस इलेक्ट्रॉनों वाले परमाणु अत्यधिक प्रतिक्रियाशील होते हैं। एक बंद खोल से कम एक या दो इलेक्ट्रॉनों वाला एक परमाणु इसकी प्रवृत्ति के कारण प्रतिक्रियाशील होता है या तो लापता वैलेंस इलेक्ट्रॉनों को प्राप्त करने और एक नकारात्मक आयन बनाने के लिए, या फिर वैलेंस इलेक्ट्रॉनों को साझा करने और एक सहसंयोजक बंधन बनाने के लिए।
एक कोर इलेक्ट्रॉन के समान, एक वैलेंस इलेक्ट्रॉन में फोटॉन के रूप में ऊर्जा को अवशोषित करने या छोड़ने की क्षमता होती है। एक ऊर्जा लाभ इलेक्ट्रॉन को बाहरी खोल में जाने (कूदने) के लिए ट्रिगर कर सकता है; इसे उत्तेजित अवस्था#परमाणु उत्तेजना के रूप में जाना जाता है। या इलेक्ट्रॉन अपने संबंधित परमाणु के खोल से मुक्त भी हो सकता है; यह सकारात्मक आयन बनाने के लिए आयनीकरण है। जब एक इलेक्ट्रॉन ऊर्जा खो देता है (जिससे एक फोटॉन उत्सर्जित होता है), तो यह एक आंतरिक खोल में जा सकता है जो पूरी तरह से व्याप्त नहीं है।
सिंहावलोकन
इलेक्ट्रॉन विन्यास
वैलेंस (रसायन विज्ञान) निर्धारित करने वाले इलेक्ट्रॉन - एक परमाणु रासायनिक रूप से कैसे प्रतिक्रिया करता है - वे उच्चतम ऊर्जा वाले हैं।
एक मुख्य-समूह तत्व के लिए, वैलेंस इलेक्ट्रॉनों को उन इलेक्ट्रॉनों के रूप में परिभाषित किया जाता है जो उच्चतम प्रमुख क्वांटम संख्या n के इलेक्ट्रॉनिक शेल में रहते हैं।[1] इस प्रकार, वैलेंस इलेक्ट्रॉनों की संख्या जो कि हो सकती है, इलेक्ट्रॉन विन्यास पर सरल तरीके से निर्भर करती है। उदाहरण के लिए, फॉस्फोरस (P) का इलेक्ट्रॉनिक विन्यास 1s है2 2s2 2p6 3से2 3p3 ताकि 5 संयोजी इलेक्ट्रॉन हों (3s2 3p3), अणु पीएफ के रूप में 5 के पी के लिए अधिकतम वैलेंस के अनुरूप5; यह कॉन्फ़िगरेशन सामान्य रूप से [Ne] 3s के लिए संक्षिप्त है2 3p3, जहां [Ne] कोर इलेक्ट्रॉनों को दर्शाता है जिसका विन्यास नोबल गैस नियॉन के समान है।
हालांकि, संक्रमण तत्वों में (n−1)d ऊर्जा स्तर होते हैं जो ऊर्जा के मामले में n के बहुत करीब होते हैंs स्तर।[2] इसलिए मुख्य-समूह तत्वों के विपरीत, एक संक्रमण धातु के लिए वैलेंस इलेक्ट्रॉन को एक ऐसे इलेक्ट्रॉन के रूप में परिभाषित किया जाता है जो नोबल-गैस कोर के बाहर रहता है।[3] इस प्रकार, आमतौर पर, संक्रमण धातुओं में d इलेक्ट्रॉन वैलेंस इलेक्ट्रॉनों के रूप में व्यवहार करते हैं, हालांकि वे सबसे बाहरी शेल में नहीं होते हैं। उदाहरण के लिए, मैंगनीज (Mn) का विन्यास 1s है2 2s2 2p6 3से2 3p6 4s2 3डी5; यह [Ar] 4s के लिए संक्षिप्त है2 3डी5, जहां [Ar] नोबल गैस आर्गन के समान कोर कॉन्फ़िगरेशन को दर्शाता है। इस परमाणु में, एक 3d इलेक्ट्रॉन में 4s इलेक्ट्रॉन के समान ऊर्जा होती है, और 3s या 3p इलेक्ट्रॉन की तुलना में बहुत अधिक होती है। वास्तव में, संभवतः सात संयोजी इलेक्ट्रॉन (4s2 3डी5) आर्गन जैसे कोर के बाहर; यह रासायनिक तथ्य के अनुरूप है कि मैंगनीज की ऑक्सीकरण अवस्था +7 जितनी अधिक हो सकती है (परमैंगनेट आयन में: MnO−
4).
प्रत्येक संक्रमण धातु श्रृंखला में सबसे आगे, विज्ञापन उपकोश में एक इलेक्ट्रॉन की ऊर्जा कम होती है और इस तरह के इलेक्ट्रॉन में वैलेंस गुण कम होते हैं। इस प्रकार, हालांकि एक निकेल परमाणु में, सिद्धांत रूप में, दस संयोजक इलेक्ट्रॉन (4s2 3डी8), इसकी ऑक्सीकरण अवस्था कभी भी चार से अधिक नहीं होती है। जिंक के लिए, 3डी सबशेल सभी ज्ञात यौगिकों में पूर्ण है, हालांकि यह कुछ यौगिकों में वैलेंस बैंड में योगदान देता है।[4] इसी तरह के पैटर्न आंतरिक संक्रमण धातुओं के (n−2)f ऊर्जा स्तरों के लिए हैं।
एक संक्रमण धातु के रसायन विज्ञान को समझने के लिए d इलेक्ट्रॉन गणना एक वैकल्पिक उपकरण है।
वैलेंस इलेक्ट्रॉनों की संख्या
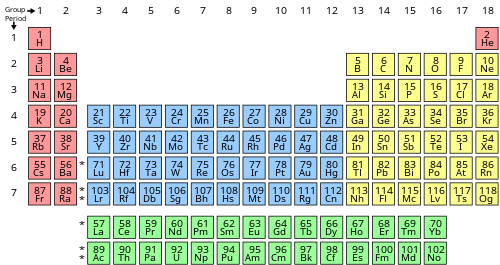
किसी तत्व के वैलेंस इलेक्ट्रॉनों की संख्या आवर्त सारणी समूह (ऊर्ध्वाधर स्तंभ) द्वारा निर्धारित की जा सकती है जिसमें तत्व को वर्गीकृत किया गया है। 1-12 समूहों में, समूह संख्या वैलेंस इलेक्ट्रॉनों की संख्या से मेल खाती है; समूह 13-18 में, समूह संख्या का इकाई अंक वैलेंस इलेक्ट्रॉनों की संख्या से मेल खाता है।[5]
| Periodic table block | Periodic table group | Valence electrons |
|---|---|---|
| s | Group 1 (I) (alkali metals) | 1 |
| Group 2 (II) (alkaline earth metals) and helium | 2 | |
| f | Lanthanides and actinides | 3–16[lower-alpha 1] |
| d | Groups 3-12 (transition metals) | 3–12[lower-alpha 2] |
| p | Group 13 (III) (boron group) | 3 |
| Group 14 (IV) (carbon group) | 4 | |
| Group 15 (V) (pnictogens or nitrogen group) | 5 | |
| Group 16 (VI) (chalcogens or oxygen group) | 6 | |
| Group 17 (VII) (halogens) | 7 | |
| Group 18 (VIII or 0) (noble gases) except helium | 8 |
हीलियम एक अपवाद है: 1s होने के बावजूददो संयोजी इलेक्ट्रॉनों के साथ 2 विन्यास, और इस प्रकार उनके ns के साथ क्षारीय पृथ्वी धातुओं के साथ कुछ समानताएँ हैं2 संयोजी विन्यास, इसका खोल पूरी तरह से भरा हुआ है और इसलिए यह रासायनिक रूप से बहुत निष्क्रिय है और आमतौर पर समूह 18 में अन्य महान गैसों के साथ रखा जाता है।
वैलेंस शेल
वैलेंस शेल परमाणु ऑर्बिटल्स का सेट है जो रासायनिक बांड बनाने के लिए इलेक्ट्रॉनों को स्वीकार करने के लिए ऊर्जावान रूप से सुलभ हैं।
मुख्य-समूह तत्वों के लिए, वैलेंस शेल में सबसे बाहरी इलेक्ट्रॉन शेल में ns और np ऑर्बिटल्स होते हैं। संक्रमण धातुओं के लिए अपूर्ण (n−1)d उपकोश के कक्षकों को शामिल किया जाता है, और लैन्थेनाइड्स और एक्टिनाइड्स के लिए अपूर्ण (n−2)f और (n−1)d उपकोशों को शामिल किया जाता है। शामिल ऑर्बिटल्स एक आंतरिक इलेक्ट्रॉन शेल में हो सकते हैं और सभी एक ही इलेक्ट्रॉन शेल या किसी दिए गए तत्व में प्रिंसिपल क्वांटम संख्या n के अनुरूप नहीं होते हैं, लेकिन वे सभी समान ऊर्जा पर होते हैं।[5]
| Element type | Hydrogen and helium | s- and p-blocks (main-group elements) |
d-block (Transition metals) |
f-block (Lanthanides and actinides) |
|---|---|---|---|---|
| Valence orbitals[6] |
|
|
|
|
| Electron counting rules | Duet/Duplet rule | Octet rule | 18-electron rule | 32-electron rule |
एक सामान्य नियम के रूप में, एक मुख्य समूह तत्व (हाइड्रोजन या हीलियम को छोड़कर) एस बनाने के लिए प्रतिक्रिया करता है2</सुप>प6 इलेक्ट्रॉन विन्यास। इस प्रवृत्ति को ऑक्टेट नियम कहा जाता है, क्योंकि प्रत्येक बंधित परमाणु में साझा इलेक्ट्रॉनों सहित 8 वैलेंस इलेक्ट्रॉन होते हैं। इसी प्रकार, एक संक्रमण धातु d बनाने के लिए प्रतिक्रिया करता है10एस2</सुप>प6 इलेक्ट्रॉन विन्यास। इस प्रवृत्ति को 18-इलेक्ट्रॉन नियम कहा जाता है, क्योंकि प्रत्येक बंधित परमाणु में साझा इलेक्ट्रॉनों सहित 18 वैलेंस इलेक्ट्रॉन होते हैं।
भारी समूह 2 तत्व कैल्शियम, स्ट्रोंटियम और बेरियम (n−1)d-शेल का भी उपयोग कर सकते हैं, जिससे उन्हें संक्रमण धातुओं में कुछ समानता मिलती है।[7][8]
रासायनिक अभिक्रियाएँ
एक परमाणु में वैलेंस इलेक्ट्रॉनों की संख्या उसके रासायनिक बंधन व्यवहार को नियंत्रित करती है। इसलिए, जिन तत्वों के परमाणुओं में वैलेंस इलेक्ट्रॉनों की समान संख्या होती है, उन्हें अक्सर तत्वों की आवर्त सारणी में एक साथ समूहीकृत किया जाता है, खासकर यदि उनके पास भी समान प्रकार के वैलेंस ऑर्बिटल्स हों।[9] सबसे प्रतिक्रियाशील (रसायन विज्ञान) प्रकार का धात्विक तत्व समूह 1 (जैसे, सोडियम या पोटेशियम) की एक क्षार धातु है; ऐसा इसलिए है क्योंकि ऐसे परमाणु में केवल एक संयोजी इलेक्ट्रॉन होता है। एक आयनिक बंधन के निर्माण के दौरान, जो आवश्यक आयनीकरण ऊर्जा प्रदान करता है, यह एक वैलेंस इलेक्ट्रॉन एक बंद शेल (जैसे, Na) के साथ एक सकारात्मक आयन (धनायन) बनाने के लिए आसानी से खो जाता है।+ या के+). समूह 2 की एक क्षारीय पृथ्वी धातु (जैसे, मैग्नीशियम) कुछ हद तक कम प्रतिक्रियाशील होती है, क्योंकि प्रत्येक परमाणु को एक बंद खोल के साथ एक सकारात्मक आयन बनाने के लिए दो वैलेंस इलेक्ट्रॉनों को खोना पड़ता है (जैसे, Mg)2+).
धातुओं के प्रत्येक समूह (प्रत्येक आवर्त सारणी स्तंभ) के भीतर, तालिका की प्रत्येक निचली पंक्ति (हल्के तत्व से भारी तत्व तक) के साथ प्रतिक्रियाशीलता बढ़ जाती है, क्योंकि एक भारी तत्व में एक हल्के तत्व की तुलना में अधिक इलेक्ट्रॉन गोले होते हैं; एक भारी तत्व के वैलेंस इलेक्ट्रॉन उच्च प्रिंसिपल क्वांटम संख्या में मौजूद होते हैं (वे परमाणु के नाभिक से दूर होते हैं, और इस प्रकार उच्च संभावित ऊर्जा पर होते हैं, जिसका अर्थ है कि वे कम मजबूती से बंधे होते हैं)।
एक पूर्ण वैलेंस शेल प्राप्त करने के लिए एक अधातु परमाणु अतिरिक्त वैलेंस इलेक्ट्रॉनों को आकर्षित करता है; यह दो तरीकों में से एक में प्राप्त किया जा सकता है: एक परमाणु या तो एक पड़ोसी परमाणु (एक सहसंयोजक बंधन) के साथ इलेक्ट्रॉनों को साझा कर सकता है, या यह दूसरे परमाणु (एक आयनिक बंधन) से इलेक्ट्रॉनों को हटा सकता है। सबसे प्रतिक्रियाशील प्रकार का अधातु तत्व एक हैलोजन (जैसे, फ्लोरीन (F) या क्लोरीन (Cl)) है। ऐसे परमाणु का निम्न इलेक्ट्रॉन विन्यास होता है: s2</सुप>प5; इसके लिए एक बंद खोल बनाने के लिए केवल एक अतिरिक्त वैलेंस इलेक्ट्रॉन की आवश्यकता होती है। एक आयनिक बंधन बनाने के लिए, एक हैलोजन परमाणु एक आयन बनाने के लिए दूसरे परमाणु से एक इलेक्ट्रॉन को हटा सकता है (उदाहरण के लिए, एफ−, क्ल−, आदि). एक सहसंयोजक बंधन बनाने के लिए, हैलोजन से एक इलेक्ट्रॉन और दूसरे परमाणु से एक इलेक्ट्रॉन एक साझा जोड़ी बनाते हैं (उदाहरण के लिए, अणु एच-एफ में, लाइन वैलेंस इलेक्ट्रॉनों की एक साझा जोड़ी का प्रतिनिधित्व करती है, एक एच से और एक एफ से)।
अधातुओं के प्रत्येक समूह के भीतर, आवर्त सारणी में तालिका की प्रत्येक निचली पंक्ति (हल्के तत्व से भारी तत्व तक) के साथ प्रतिक्रियाशीलता कम हो जाती है, क्योंकि वैलेंस इलेक्ट्रॉन उत्तरोत्तर उच्च ऊर्जा पर होते हैं और इस प्रकार उत्तरोत्तर कम कसकर बंधे होते हैं। वास्तव में, ऑक्सीजन (समूह 16 में सबसे हल्का तत्व) फ्लोरीन के बाद सबसे अधिक प्रतिक्रियाशील गैर-धातु है, भले ही यह हैलोजन नहीं है, क्योंकि हैलोजन का वैलेंस शेल एक उच्च प्रिंसिपल क्वांटम संख्या पर है।
इन सरल मामलों में जहां ऑक्टेट नियम का पालन किया जाता है, एक परमाणु की वैलेंस (रसायन विज्ञान) स्थिर ऑक्टेट बनाने के लिए प्राप्त, खोए या साझा किए गए इलेक्ट्रॉनों की संख्या के बराबर होती है। हालाँकि, ऐसे कई अणु भी हैं जो ऑक्टेट नियम # अपवाद हैं, और जिसके लिए वैलेंस कम स्पष्ट रूप से परिभाषित है।
विद्युत चालकता
किसी तत्व की विद्युत चालकता के लिए वैलेंस इलेक्ट्रॉन भी जिम्मेदार होते हैं; परिणामस्वरूप, एक तत्व को धातु, अधातु, या उपधातु (जिनमें से कई अर्धचालक हैं) के रूप में वर्गीकृत किया जा सकता है।
Template:Periodic table (metals and nonmetals) ठोस अवस्था में धात्विक तत्वों में आमतौर पर उच्च विद्युत चालक होते हैं। आवर्त सारणी (धातु और अधातु) की प्रत्येक पंक्ति में, धातुएँ अधातुओं के बाईं ओर होती हैं, और इस प्रकार एक धातु में अधातु की तुलना में कम संयोजी इलेक्ट्रॉन होते हैं। हालांकि, एक धातु परमाणु के वैलेंस इलेक्ट्रॉन में एक छोटी आयनीकरण ऊर्जा होती है, और ठोस अवस्था में यह वैलेंस इलेक्ट्रॉन एक परमाणु को छोड़ने के लिए अपेक्षाकृत स्वतंत्र होता है ताकि पास के दूसरे से जुड़ सके। इस तरह के एक मुक्त इलेक्ट्रॉन को विद्युत क्षेत्र के प्रभाव में स्थानांतरित किया जा सकता है, और इसकी गति से विद्युत प्रवाह बनता है; यह धातु की विद्युत चालकता के लिए जिम्मेदार है। कॉपर, एल्युमिनियम, सिल्वर और गोल्ड अच्छे कंडक्टर के उदाहरण हैं।
एक अधातु तत्व में कम विद्युत चालकता होती है; यह एक इन्सुलेटर (इलेक्ट्रिकल) के रूप में कार्य करता है। ऐसा तत्व आवर्त सारणी के दाईं ओर पाया जाता है, और इसमें एक वैलेंस शेल होता है जो कम से कम आधा भरा होता है (अपवाद बोरॉन है)। इसकी आयनीकरण ऊर्जा बड़ी है; एक विद्युत क्षेत्र लागू होने पर एक इलेक्ट्रॉन एक परमाणु को आसानी से नहीं छोड़ सकता है, और इस प्रकार ऐसा तत्व केवल बहुत कम विद्युत धाराओं का संचालन कर सकता है। ठोस मौलिक इंसुलेटर के उदाहरण हीरा (कार्बन का एक आवंटन) और सल्फर हैं।
धातुओं से युक्त एक ठोस यौगिक भी एक इन्सुलेटर हो सकता है यदि धातु परमाणुओं के वैलेंस इलेक्ट्रॉनों का उपयोग आयनिक बांड बनाने के लिए किया जाता है। उदाहरण के लिए, हालांकि प्राथमिक सोडियम एक धातु है, ठोस सोडियम क्लोराइड एक इन्सुलेटर है, क्योंकि सोडियम के संयोजी इलेक्ट्रॉन को आयनिक बंधन बनाने के लिए क्लोरीन में स्थानांतरित किया जाता है, और इस प्रकार उस इलेक्ट्रॉन को आसानी से स्थानांतरित नहीं किया जा सकता है।
एक अर्धचालक में एक विद्युत चालकता होती है जो एक धातु और एक अधातु के बीच मध्यवर्ती होती है; एक अर्धचालक भी एक धातु से भिन्न होता है जिसमें एक अर्धचालक की चालकता तापमान के साथ बढ़ जाती है। विशिष्ट तात्विक अर्धचालक सिलिकॉन और जर्मेनियम हैं, जिनमें से प्रत्येक परमाणु में चार वैलेंस इलेक्ट्रॉन होते हैं। वैलेंस बैंड (जिसमें पूर्ण शून्य पर वैलेंस इलेक्ट्रॉन होते हैं) और एक कंडक्शन बैंड (जिसमें वैलेंस इलेक्ट्रॉन थर्मल ऊर्जा से उत्साहित होते हैं) के बीच एक छोटे से ऊर्जा अंतर के परिणामस्वरूप सेमीकंडक्टर्स के गुणों को बैंड सिद्धांत का उपयोग करके सबसे अच्छी तरह से समझाया जाता है।
संदर्भ
- ↑ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). सामान्य रसायन विज्ञान: सिद्धांत और आधुनिक अनुप्रयोग (8th ed.). Upper Saddle River, N.J: Prentice Hall. p. 339. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
- ↑ THE ORDER OF FILLING 3d AND 4s ORBITALS. chemguide.co.uk
- ↑ Miessler G.L. and Tarr, D.A., Inorganic Chemistry (2nd edn. Prentice-Hall 1999). p.48.
- ↑ Tossell, J. A. (1 November 1977). "सॉलिड जिंक सल्फाइड, जिंक ऑक्साइड और जिंक फ्लोराइड में वैलेंस ऑर्बिटल बाइंडिंग एनर्जी का सैद्धांतिक अध्ययन". Inorganic Chemistry. 16 (11): 2944–2949. doi:10.1021/ic50177a056.
- ↑ 5.0 5.1 Keeler, James; Wothers, Peter (2014). रासायनिक संरचना और प्रतिक्रियाशीलता (2nd ed.). Oxford University Press. pp. 257–260. ISBN 978-0-19-9604135.
- ↑ Chi, Chaoxian; Pan, Sudip; Jin, Jiaye; Meng, Luyan; Luo, Mingbiao; Zhao, Lili; Zhou, Mingfei; Frenking, Gernot (2019). "Octacarbonyl Ion Complexes of Actinides [An(CO)8]+/− (An=Th, U) and the Role of f Orbitals in Metal–Ligand Bonding". Chem. Eur. J. 25 (50): 11772–11784. doi:10.1002/chem.201902625. PMC 6772027. PMID 31276242.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 117. ISBN 978-0-08-037941-8.
- ↑ Zhou, Mingfei; Frenking, Gernot (2021). "भारी क्षारीय पृथ्वी परमाणुओं Ca, Sr, और Ba का संक्रमण-धातु रसायन". Accounts of Chemical Research. 54 (15): 3071–3082. doi:10.1021/acs.accounts.1c00277.
- ↑ Jensen, William B. (2000). "आवधिक कानून और तालिका" (PDF). Retrieved 10 December 2022.
इस पेज में लापता आंतरिक लिंक की सूची
बाहरी संबंध
- Francis, Eden. Valence Electrons.
- Templates that generate short descriptions
- Collapse templates
- Navigational boxes
- Navigational boxes without horizontal lists
- Sidebars with styles needing conversion
- Templates generating microformats
- Templates that are not mobile friendly
- Wikipedia metatemplates
- रासायनिक बंधन
- इलेक्ट्रॉन स्थिति
- Machine Translated Page
- Created On 12/12/2022