सल्फाइड
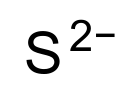
| |
| Names | |
|---|---|
| Systematic IUPAC name | |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| S2− | |
| Molar mass | 32.06 g·mol−1 |
| Conjugate acid | Bisulfide |
| Related compounds | |
Other anions
|
oxide selenide Telluride |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
सल्फाइड (ब्रिटिश अंग्रेजी भी सल्फाइड)[2] सल्फर का एक अकार्बनिक आयन है जिसका रासायनिक सूत्र S2- या एक यौगिक है जिसमें एक या अधिक S2- आयन होते हैं। सल्फाइड लवण के घोल संक्षारक होते हैं। सल्फाइड अकार्बनिक और कार्बनिक यौगिक के बड़े परिवारों के रासायनिक यौगिकों को भी संदर्भित करता है, उदा-लेड सल्फाइड और डाइमिथाइल सल्फाइड। हाइड्रोजन सल्फाइड (H2S) और बाइसल्फ़ाइड (SH−) सल्फाइड के संयुग्मित अम्ल हैं।
रासायनिक गुण
सल्फाइड आयन, S2−, Na2S के जलीय क्षारीय विलयनों में मौजूद नहीं होता है।[3][4] इसके बजाय सल्फाइड हाइड्रोसल्फाइड में परिवर्तित हो जाता है:
- S2− + H2O → SH− + OH−
अम्ल के उपचार पर, सल्फाइड लवण हाइड्रोजन सल्फाइड में परिवर्तित हो जाते हैं:
- S2− + H+ → SH−
- SH− + H+ → H2S
सल्फाइड का ऑक्सीकरण एक जटिल प्रक्रिया है। शर्तों के आधार पर, ऑक्सीकरण प्राथमिक सल्फर, पॉलीसल्फाइड्स, पॉलीथियोनेट्स, सल्फाइट या सल्फेट का उत्पादन कर सकता है। धातु सल्फाइड हैलोजन के साथ अभिक्रिया करता है, जिससे सल्फर और धातु के लवण बनते हैं।
- 8 MgS + 8 I2 → S8 + 8 MgI2
धातु व्युत्पत्ति
संक्रमण धातुओं के जलीय विलयन ठोस सल्फाइड को अवक्षेपित करने के लिए सल्फाइड स्रोतों (H2S, NaHS, Na2S) के साथ अभिक्रिया करते हैं। इस तरह के अकार्बनिक सल्फाइड में समान्यता जल में बहुत कम घुलनशीलता होती है, और कई समान संरचना वाले खनिजों से संबंधित होते हैं (नीचे देखें)। एक प्रसिद्ध उदाहरण चमकीली पीली प्रजाति CdS या कैडमियम पीला है। स्टर्लिंग चांदी पर बनने वाला काला धब्बा Ag2S है। ऐसी प्रजातियों को कभी-कभी लवण के रूप में जाना जाता है। वास्तव में, संक्रमण धातु सल्फाइड में बंधन अत्यधिक सहसंयोजक होता है, जो उनके अर्धचालक गुणों को जन्म देता है, जो बदले में गहरे रंगों से संबंधित होता है। कई में वर्णक के रूप में, सौर कोशिकाओं में और उत्प्रेरक के रूप में व्यावहारिक अनुप्रयोग हैं। कवक एस्परजिलस नाइजर भारी धातु सल्फाइड के विलेयकरण में एक भूमिका निभाता है।[5]
भूविज्ञान
कई महत्वपूर्ण धातु अयस्क सल्फाइड हैं।[6] महत्वपूर्ण उदाहरणों में सम्मलित हैं: अर्जेन्टाइट ( सिल्वर सल्फाइड), सिनबर (मर्करी(पारा) सल्फाइड), गैलिना (लेड सल्फाइड), मोलिब्डेनाईट (मोलिब्डेनम सल्फाइड), पेंटलैंडाइट (निकल सल्फाइड), रियलगर (आर्सेनिक सल्फाइड), और स्टिबनाइट (सुरमा ), स्पैलेराइट (जिंक सल्फाइड), और पाइराइट (लौह डाइसल्फ़ाइड), और च्लोकोपीराइट (लौह-तांबा सल्फाइड)। इस सल्फाइड खनिजों ने अपने गठन के दौरान अपने आसपास के वातावरण की जानकारी (जैसे समस्थानिक) दर्ज की। वैज्ञानिक इन खनिजों का उपयोग गहरे समुद्र में या पृथ्वी के अतीत में वातावरण का अध्ययन करने के लिए करते हैं|
सल्फाइड से प्रेरित संक्षारण
घुलित मुक्त सल्फाइड (H2S, HS− और S2−) इस्पात, स्टेनलेस इस्पात और तांबे जैसी कई धातुओं के क्षरण के लिए बहुत आक्रामक प्रजातियां हैं। जलीय घोल में मौजूद सल्फाइड इस्पात के तनाव जंग खुर (SCC) के लिए जिम्मेदार होते हैं, और इसे सल्फाइड तनाव खुर के रूप में भी जाना जाता है। सल्फाइड प्रसंस्करण करने वाले कई औद्योगिक प्रतिष्ठानों में जंग एक प्रमुख चिंता का विषय है: सल्फाइड अयस्क मिलें, गहरे तेल के कुएं, खट्टे तेल की ढुलाई करने वाली पाइपलाइनें और क्राफ्ट पेपर(कागज) कारखाने।
माइक्रोबियल(सूक्ष्मजैविक) रूप से प्रेरित जंग (MIC) या जैव रासायनिक सल्फाइड जंग भी सल्फेट को कम करने वाले जीवाणु के कारण होता है जो सल्फाइड का उत्पादन करता है जो हवा में उत्सर्जित होता है और सल्फर ऑक्सीकरण जीवाणु द्वारा सल्फ्यूरिक अम्ल में ऑक्सीकृत होता है। जीवजनित सल्फ्यूरिक अम्ल मल सामग्री के साथ अभिक्रिया करता है और समान्यता बड़े पैमाने पर नुकसान, गंदा नाला के पाइपों की दरार और अंततः संरचनात्मक पतन का कारण बनता है। इस तरह की गिरावट दुनिया भर में सीवर(मल ) प्रणाली को प्रभावित करने वाली एक प्रमुख प्रक्रिया है और इसके कारण पुनर्वास लागत बहुत अधिक है।
सल्फाइड के ऑक्सीकरण से थायोसल्फेट भी बन सकता है (S
2O2−
3) एक मध्यवर्ती प्रजाति इस्पात और स्टेनलेस इस्पात के क्षरण की गंभीर समस्याओं के लिए जिम्मेदार है, जबकि ऑक्सीकरण अधिक उन्नत होने पर सल्फ्यूरिक अम्ल के उत्पादन से माध्यम भी अम्लीकृत होता है।
कार्बनिक रसायन विज्ञान
कार्बनिक रसायन विज्ञान में, सल्फाइड समान्यता लिंकेज(कड़ी) C–S–C को संदर्भित करता है, यद्यपि थिओथर शब्द कम अस्पष्ट है। उदाहरण के लिए,थियोईथर डाइमिथाइल सल्फाइड CH3–S–CH3 है| पॉलीफेनिलीन सल्फाइड (नीचे देखें) का अनुभवजन्य सूत्र C6H4S है। कभी-कभी, सल्फाइड शब्द -SH कार्यात्मक समूह वाले अणुओं को संदर्भित करता है। उदाहरण के लिए, मिथाइल सल्फाइड का मतलब CH3–SH हो सकता है। ऐसे SH युक्त यौगिकों के लिए पसंदीदा वर्णनकर्ता थिओल या मर्कैप्टन है, अर्थात मेथेनेथिओल, या मिथाइल मर्कैप्टन।
डाइसल्फाइड्स
डाइसल्फ़ाइड शब्द के विभिन्न अर्थों से भ्रम उत्पन्न होता है। मोलिब्डेनम डाइसल्फ़ाइड (MoS2) में अलग-अलग सल्फाइड केंद्र होते हैं, औपचारिक +4 ऑक्सीकरण अवस्था में मोलिब्डेनम के साथ मिलकर (अर्थात, Mo4 + और दो S2−)। दूसरी ओर लौह डाइसल्फ़ाइड (पाइराइट, FeS2) में S2−
2 होता है, या −S–S− डायनियन, औपचारिक +2 ऑक्सीकरण अवस्था (लौह आयन: Fe2+) में द्विसंयोजी लौह के साथ मिलकर| डाइमिथाइलडिसल्फ़ाइड में रासायनिक बंधन CH3–S–S–CH3 है , जबकि कार्बन डाइसल्फ़ाइड में कोई S-S बंधन नहीं है, S=C=S (CO2 के अनुरूप रैखिक अणु)| प्रायः सल्फर रसायन और जैव रसायन में, डाइसल्फ़ाइड शब्द को समान्यता पेरोक्साइड-O-O-बंधन के सल्फर एनालॉग(अनुरूप) के रूप में वर्णित किया जाता है। डाइसल्फ़ाइड बंधन (–S–S–) प्रोटीन की रचना और एंजाइम की उत्प्रेरक गतिविधि में एक प्रमुख भूमिका निभाता है।
उदाहरण
| सूत्र | गलनांक बिंदु(°C) | क्वथन बिंदु(°C) | CAS संख्या | |
|---|---|---|---|---|
| H2S | हाइड्रोजन सल्फाइड एक बहुत ही जहरीली और संक्षारक गैस है जिसकी विशेषता "सड़े हुए अंडे" की एक विशिष्ट गंध है। | −85.7 | −60.20 | 7783-06-4 |
| CdS | कैडमियम सल्फाइड का उपयोग फोटोसेल में किया जा सकता है। | 1750 | 1306-23-6 | |
| कैल्शियम पॉलीसल्फ़ाइड ("लाइम सल्फर") बागवानी में एक पारंपरिक कवकनाशी है। | ||||
| CS2 | कार्बन डाइसल्फ़ाइड ऑर्गनोसल्फ़र यौगिकों का अग्रदूत है। | −111.6 | 46 | 75-15-0 |
| PbS | लेड सल्फाइड का उपयोग इन्फ्रा-रेड(लाल) सेंसर में किया जाता है। | 1114 | 1314-87-0 | |
| MoS2 | मोलिब्डेनम डाइसल्फ़ाइड, खनिज मोलिब्डेनाइट, जीवाश्म ईंधन से सल्फर को हटाने के लिए एक उत्प्रेरक के रूप में उपयोग किया जाता है; उच्च तापमान और उच्च दबाव वाले अनुप्रयोगों के लिए स्नेहक के रूप में भी। | 1317-33-5 | ||
| Cl–CH2CH2–S–CH2CH2–Cl | सल्फर मस्टर्ड (मस्टर्ड गैस) एक ऑर्गोसल्फर यौगिक (थियोईथर) है जिसे प्रथम विश्व युद्ध में रासायनिक हथियार के रूप में इस्तेमाल किया गया था। | 13–14 | 217 | 505-60-2 |
| Ag2S | सिल्वर सल्फाइड सिल्वर टार्निश का एक घटक होता है। | 21548-73-2 | ||
| Na2S | सोडियम सल्फाइड, हाइड्रेट के रूप में, क्राफ्ट पेपर के निर्माण में और ऑर्गोसल्फर यौगिकों के अग्रदूत के रूप में उपयोग किया जाता है। | 920 | 1180 | 1313-82-2 |
| ZnS | स्पेक्ट्रम के इन्फ्रारेड हिस्से में लेंस और अन्य प्रकाशीय उपकरणों के लिए जिंक सल्फाइड का उपयोग किया जाता है। चांदी के साथ ZnS-डोप्ड का उपयोग अल्फा डिटेक्टरों(पता लगाने वाले) में किया जाता है, जबकि तांबे के निशान के साथ जिंक सल्फाइड में आपातकालीन प्रकाश व्यवस्था और चमकदार घड़ी डायल के लिए फोटोल्यूमिनेसेंट पट्टी में अनुप्रयोग होते हैं। | 1185 | 1314-98-3 | |
| C6H4S | पॉलीफेनिलीन सल्फाइड एक बहुलक है जिसे समान्यता "सल्फर" कहा जाता है। इसकी दोहराई जाने वाली इकाइयाँ सल्फाइड (थियोईथर) संपर्क द्वारा एक साथ बंधी होती हैं। | 26125-40-6 25212-74-2 | ||
| SeS2 | सेलेनियम डाइसल्फ़ाइड एक रोगाणुरोधी है जिसका उपयोग रूसी रोधक तैयारियों में किया जाता है, जैसे सेल्सन ब्लू। स्वास्थ्य देखभाल और सौंदर्य प्रसाधन उत्पादों में अत्यधिक विषैले सेलेनियम की उपस्थिति एक सामान्य स्वास्थ्य और पर्यावरण संबंधी चिंता का प्रतिनिधित्व करती है। | <100 | 7488-56-4 | |
| FeS2 | पाइराइट, "फ़ूल्स गोल्ड" के रूप में जाना जाता है, एक सामान्य खनिज है। | 600 | 1317-66-4 |
तैयारी
सल्फाइड यौगिकों को कई अलग-अलग तरीकों से तैयार किया जा सकता है:[7]
- तत्वों का प्रत्यक्ष संयोजन:
- उदाहरण: Fe(s) + S(s) → FeS(s)
- सल्फेट की कमी:
- उदाहरण: MgSO4(s) + 4C(s) → MgS(s) + 4CO(g)
- एक अघुलनशील सल्फाइड का अवक्षेपण:
- उदाहरण: M2+ + H2S(g) → MS(s) + 2H+(aq)
सुरक्षा
कई धातु सल्फाइड जल में इतने अघुलनशील होते हैं कि वे शायद बहुत जहरीले नहीं होते हैं। कुछ धातु सल्फाइड, जब आमाशय अम्ल सहित एक मजबूत खनिज अम्ल के संपर्क में आते हैं, तो जहरीले हाइड्रोजन सल्फाइड को छोड़ देंगे।
कार्बनिक सल्फाइड अत्यधिक ज्वलनशील होते हैं। जब एक सल्फाइड जलता है तो यह सल्फर डाइऑक्साइड (SO2) गैस उत्पन्न करता है।
हाइड्रोजन सल्फाइड, इसके कुछ लवण, और लगभग सभी कार्बनिक सल्फाइड में एक मजबूत और सड़ी हुई गंध होती है; सड़े हुए बायोमास इन्हें छोड़ देते हैं।
नामकरण
व्यवस्थित नाम सल्फानेडिइड और सल्फाइड (2-), वैध IUPAC (शुद्ध और व्यावहारिक रसायन के अंतर्राष्ट्रीय संघ) नाम क्रमशः प्रतिस्थापन और योगात्मक नामकरण के अनुसार निर्धारित किए जाते हैं। यद्यपि, नाम सल्फाइड का उपयोग संरचनागत IUPAC नामकरण में भी किया जाता है जो सम्मलित बंधन की प्रकृति को नहीं लेता है। ऐसे नामकरण के उदाहरणों में सेलेनियम डाइसल्फ़ाइड और टाइटेनियम सल्फाइड सम्मलित हैं, जिनमें सल्फाइड आयन नहीं होते हैं।
संदर्भ
- ↑ 1.0 1.1 "sulfide(2−) (CHEBI:15138)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute.
- ↑ "सल्फाइड अंग्रेजी परिभाषा और अर्थ". Lexico.com. Archived from the original on August 2, 2019. Retrieved 2022-08-24.
- ↑ May, P.M.; Batka, D.; Hefter, G.; Könignberger, E.; Rowland, D. (2018). "Goodbye to S2-". Chem. Comm. 54 (16): 1980–1983. doi:10.1039/c8cc00187a. PMID 29404555.
- ↑ Meyer, B; Ward, K; Koshlap, K; Peter, L (1983). "हाइड्रोजन सल्फाइड का दूसरा पृथक्करण स्थिरांक". Inorganic Chemistry. 22 (16): 2345. doi:10.1021/ic00158a027.
- ↑ Harbhajan Singh (17 November 2006). Mycoremediation: Fungal Bioremediation. p. 509. ISBN 9780470050583.
- ↑ Vaughan, D. J.; Craig, J. R. “Mineral chemistry of metal sulfides" Cambridge University Press, Cambridge: 1978. ISBN 0-521-21489-0.
- ↑ Atkins; Shriver (2010). अकार्बनिक रसायन शास्त्र (5th ed.). New York: W. H. Freeman & Co. p. 413.
बाहरी संबंध
 Media related to Sulfides at Wikimedia Commons
Media related to Sulfides at Wikimedia Commons
- Templates that generate short descriptions
- Articles without InChI source
- Articles without KEGG source
- Pages using collapsible list with both background and text-align in titlestyle
- Articles containing unverified chemical infoboxes
- Chembox image size set
- आयनों
- जंग
- सल्फाइड
- कार्यात्मक समूह
- सल्फर आयन
- Machine Translated Page
- Created On 02/03/2023
- Vigyan Ready