ग्रैनुलोसाइट-मैक्रोफेज कॉलोनी-उत्तेजक कारक
An Error has occurred retrieving Wikidata item for infobox
| Granulocyte-macrophage colony-stimulating factor | |||||||||
|---|---|---|---|---|---|---|---|---|---|
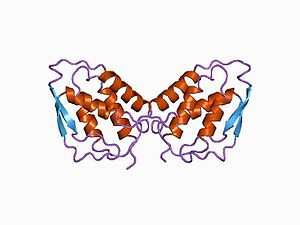 three-dimensional structure of recombinant human granulocyte-macrophage colony-stimulating factor (rhGM_CSF) | |||||||||
| Identifiers | |||||||||
| Symbol | GM_CSF | ||||||||
| Pfam | PF01109 | ||||||||
| Pfam clan | CL0053 | ||||||||
| InterPro | IPR000773 | ||||||||
| PROSITE | PDOC00584 | ||||||||
| SCOP2 | 2gmf / SCOPe / SUPFAM | ||||||||
| |||||||||
 | |
| Clinical data | |
|---|---|
| ATC code | |
| Identifiers | |
| |
| CAS Number | |
| DrugBank | |
| ChemSpider |
|
| Chemical and physical data | |
| Formula | C639H1006N168O196S8 |
| Molar mass | 14434.54 g·mol−1 |
| | |
ग्रैनुलोसाइट-बृहतभक्षककोशिका कॉलोनी-उत्तेजक कारक (GM-CSF), जिसे कॉलोनी-उत्तेजक कारक 2 (CSF2) के रूप में भी जाना जाता है, मैक्रोफेज, टी कोशिकाओं, मस्तूल कोशिकाओं, प्राकृतिक किलर कोशिकाओंअन्तःस्तरीय कोशिका कोशिकाओं और तंतुकोशिका द्वारा स्रावित एक मोनोमेरिक ग्लाइकोप्रोटीन है। एक साइटोकाइन स्वाभाविक रूप से होने वाले GM-CSF के दवा दवा एनालॉग्स को sargramostim और Molgramostim कहा जाता है।
ग्रैनुलोसाइट कॉलोनी-उत्तेजक कारक के विपरीत, जो विशेष रूप से न्युट्रोफिल प्रसार और परिपक्वता को बढ़ावा देता है, जीएम-सीएसएफ अधिक सेल प्रकारों, विशेष रूप से मैक्रोफेज और eosinophil को प्रभावित करता है।[1]
समारोह
GM-CSF एक मोनोमेरिक ग्लाइकोप्रोटीन है जो साइटोकिन के रूप में कार्य करता है - यह एक श्वेत रक्त कोशिका वृद्धि कारक है।[2] GM-CSF स्टेम कोशिका को कणांकुर ्स (न्यूट्रोफिल, ईोसिनोफिल और बेसोफिल ) और एककेंद्रकश्वेतकोशिका ्स बनाने के लिए उत्तेजित करता है। मोनोसाइट्स संचलन से बाहर निकलते हैं और ऊतक में चले जाते हैं, जिसके बाद वे मैक्रोफेज और डेंड्राइटिक कोशिकाओं में परिपक्व हो जाते हैं। इस प्रकार, यह प्रतिरक्षा प्रणाली/सूजन जैव रासायनिक झरना का हिस्सा है, जिसके द्वारा मैक्रोफेज की एक छोटी संख्या की सक्रियता से उनकी संख्या में तेजी से वृद्धि हो सकती है, जो संक्रमण से लड़ने के लिए महत्वपूर्ण प्रक्रिया है।
GM-CSF का प्रतिरक्षा प्रणाली की परिपक्व कोशिकाओं पर भी कुछ प्रभाव पड़ता है। इनमें शामिल हैं, उदाहरण के लिए, न्युट्रोफिल प्रवास को बढ़ाना और कोशिकाओं की सतह पर व्यक्त रिसेप्टर्स में परिवर्तन करना।[3] GM-CSF सिग्नल ट्रांसड्यूसर और ट्रांसक्रिप्शन के एक्टिवेटर, STAT5 के माध्यम से संकेत देता है।[4] मैक्रोफेज में, यह STAT3 के माध्यम से संकेत देने के लिए भी दिखाया गया है। साइटोकिन मैक्रोफेज को फंगल के अस्तित्व को रोकने के लिए सक्रिय करता है। यह इंट्रासेल्युलर मुक्त जस्ता में कमी को प्रेरित करता है और प्रतिक्रियाशील ऑक्सीजन प्रजातियों के उत्पादन को बढ़ाता है जो कवक जस्ता भुखमरी और विषाक्तता में परिणत होता है।[5] इस प्रकार, जीएम-सीएसएफ प्रतिरक्षा प्रणाली के विकास की सुविधा प्रदान करता है और संक्रमणों से बचाव को बढ़ावा देता है।
GM-CSF प्रजनन पथ द्वारा उत्पादित भ्रूण काइन के रूप में कार्य करके भ्रूण के विकास में भी भूमिका निभाता है।[6]
जेनेटिक्स
मानव जीन को क्रोमोसोम क्षेत्र 5q31 में टी हेल्पर सेल टाइप 2-जुड़े साइटोकाइन जीन क्लस्टर के भीतर इंटरल्यूकिन 3 जीन के करीब स्थानीयकृत किया गया है, जिसे 5q- सिंड्रोम और तीव्र माइलोजेनस ल्यूकेमिया में अंतरालीय विलोपन से जुड़ा हुआ माना जाता है। GM-CSF और IL-3 को एक इन्सुलेटर तत्व द्वारा अलग किया जाता है और इस प्रकार स्वतंत्र रूप से विनियमित किया जाता है।[7] क्लस्टर में अन्य जीनों में वे एन्कोडिंग इंटरल्यूकिन 4 , इंटरल्यूकिन 5 और इंटरल्यूकिन 13 शामिल हैं।[8]
ग्लाइकोसिलेशन
मानव ग्रैनुलोसाइट-मैक्रोफेज कॉलोनी-उत्तेजक कारक अपने परिपक्व रूप में ग्लाइकोसिलेटेड है।
इतिहास
GM-CSF को पहली बार 1985 में क्लोन किया गया था, और इसके तुरंत बाद पुनः संयोजक डीएनए तकनीक का उपयोग करके तीन संभावित दवा उत्पाद बनाए जा रहे थे: मोल्ग्रामोस्टिम को एस्चेरिचिया कोलाई में बनाया गया था और यह ग्लाइकोसिलेटेड नहीं है, sargramostim को खमीर में बनाया गया था, 23 की स्थिति में प्रोलाइन के बजाय एक ल्यूसीन है और कुछ हद तक ग्लाइकोसिलेटेड है, और yogi चीनी हम्सटर अंडाशय कोशिकाओं (सीएचओ) में बनाया गया था और इसमें सरग्रामोस्टिम की तुलना में अधिक ग्लाइकोसिलेशन है। ग्लाइकोसिलेशन की मात्रा प्रभावित करती है कि शरीर दवा के साथ कैसे संपर्क करता है और दवा शरीर के साथ कैसे संपर्क करती है।[9] उस समय, जेनेटिक्स इंस्टीट्यूट, इंक. मोल्ग्रामोस्टिम पर काम कर रहा था,[10] Immunex sargramostim (Leukine) पर काम कर रहा था,[11] और संदोज़ ़ रेग्रामोस्टिम पर काम कर रहे थे।[12] मोल्ग्रामोस्टिम को अंततः नोवार्टिस और शेरिंग-प्लो द्वारा व्यापार नाम ल्यूकोमैक्स के तहत सह-विकसित और सह-विपणित किया गया था, जो कीमोथेरेपी के बाद सफेद रक्त कोशिका के स्तर को ठीक करने में मदद करने के लिए उपयोग किया गया था, और 2002 में नोवार्टिस ने शेरिंग-प्लो को अपने अधिकार बेच दिए।[13][14] सारग्रामोस्टिम को 1991 में व्यापार नाम ल्यूकाइन के तहत ऑटोलॉगस बोन मैरो प्रत्यारोपण के बाद श्वेत रक्त कोशिका की रिकवरी में तेजी लाने के लिए यूएस एफडीए द्वारा अनुमोदित किया गया था, और कई हाथों से गुजरा, जो कि Genzyme के साथ समाप्त हुआ।[15] जिसे बाद में सनोफी ने अधिग्रहित कर लिया। Leukine का स्वामित्व अब Partner Therapeutics (PTx) के पास है।
Imlygic को अक्टूबर 2015 में US FDA द्वारा अनुमोदित किया गया था,[16] और दिसंबर 2015 में EMA द्वारा, एक ऑनकोलिटिक वीरोथेरेपी के रूप में, Amgen Inc. द्वारा व्यावसायीकरण किया गया। इस ओंकोलिटिक दाद वायरस , जिसका नाम Talimogene laherparepvec है, को ट्यूमर सेल मशीनरी का उपयोग करके मानव GM-CSF को व्यक्त करने के लिए आनुवंशिक रूप से इंजीनियर किया गया है।[17]
नैदानिक महत्व
जीएम-सीएसएफ संधिशोथ वाले जोड़ों में उच्च स्तर में पाया जाता है और जीएम-सीएसएफ को जैविक लक्ष्य के रूप में अवरुद्ध करने से सूजन या क्षति कम हो सकती है। जीएम-सीएसएफ को अवरुद्ध करने के लिए कुछ दवाएं (जैसे ओटिलिमाब ) विकसित की जा रही हैं।[18] गंभीर रूप से बीमार मरीजों में GM-CSF को गंभीर बीमारी के इम्यूनोसप्रेशन के लिए एक थेरेपी के रूप में आजमाया गया है, और मोनोसाइट को बहाल करने का वादा दिखाया है[19] और न्यूट्रोफिल[20] कार्य, हालांकि रोगी के परिणामों पर प्रभाव वर्तमान में अस्पष्ट है और बड़े अध्ययनों की प्रतीक्षा कर रहा है।
GM-CSF, CCL17 सहित प्रो-इन्फ्लेमेटरी साइटोकिन्स का उत्पादन करने के लिए मोनोसाइट्स और मैक्रोफेज को उत्तेजित करता है।[21]उन्नत जीएम-सीएसएफ को भड़काऊ गठिया , पुराने ऑस्टियोआर्थराइटिस , सूजन और जलन दमा , मोटापा और कोरोनावाइरस रोग 2019 | COVID-19 में सूजन में योगदान करने के लिए दिखाया गया है।[21][22][23]
नैदानिक परीक्षण
GM-CSF के खिलाफ मोनोक्लोनल ऐंटीबॉडी का उपयोग रूमेटाइड आर्थराइटिस, रीढ़ के जोड़ों में गतिविधि-रोधक सूजन और COVID-19 के खिलाफ नैदानिक परीक्षणों में उपचार के रूप में किया जा रहा है।[21]
यह भी देखें
- CFU-जीएम
- फिल्ग्रास्टिम (न्यूपोजेन, एक ग्रैनुलोसाइट कॉलोनी-उत्तेजक कारक (जी-सीएसएफ) एनालॉग)
- ग्रैनुलोसाइट-मैक्रोफेज कॉलोनी-उत्तेजक कारक रिसेप्टर
- यह किताब है
- Pegfilgrastim (Neulasta, एक PEGylated रूप filgrastim)
संदर्भ
- ↑ Root RK, Dale DC (March 1999). "Granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor: comparisons and potential for use in the treatment of infections in nonneutropenic patients". The Journal of Infectious Diseases. 179 Suppl 2 (Suppl 2): S342-52. doi:10.1086/513857. PMID 10081506.
- ↑ Francisco-Cruz A, Aguilar-Santelises M, Ramos-Espinosa O, Mata-Espinosa D, Marquina-Castillo B, Barrios-Payan J, Hernandez-Pando R (January 2014). "Granulocyte-macrophage colony-stimulating factor: not just another haematopoietic growth factor". Medical Oncology. 31 (1): 774. doi:10.1007/s12032-013-0774-6. PMID 24264600. S2CID 24452892.
- ↑ Gasson JC (March 1991). "Molecular physiology of granulocyte-macrophage colony-stimulating factor". Blood. 77 (6): 1131–45. doi:10.1182/blood.V77.6.1131.1131. PMID 2001448.
- ↑ Voehringer D (October 2012). "Basophil modulation by cytokine instruction". European Journal of Immunology. 42 (10): 2544–50. doi:10.1002/eji.201142318. PMID 23042651. S2CID 23972211.
- ↑ Subramanian Vignesh K, Landero Figueroa JA, Porollo A, Caruso JA, Deepe GS (October 2013). "Granulocyte macrophage-colony stimulating factor induced Zn sequestration enhances macrophage superoxide and limits intracellular pathogen survival". Immunity. 39 (4): 697–710. doi:10.1016/j.immuni.2013.09.006. PMC 3841917. PMID 24138881.
- ↑ Hansen PJ, Dobbs KB, Denicol AC (September 2014). "Programming of the preimplantation embryo by the embryokine colony stimulating factor 2". Animal Reproduction Science. 149 (1–2): 59–66. doi:10.1016/j.anireprosci.2014.05.017. PMID 24954585.
- ↑ Bowers SR, Mirabella F, Calero-Nieto FJ, Valeaux S, Hadjur S, Baxter EW, et al. (April 2009). "A conserved insulator that recruits CTCF and cohesin exists between the closely related but divergently regulated interleukin-3 and granulocyte-macrophage colony-stimulating factor genes". Molecular and Cellular Biology. 29 (7): 1682–93. doi:10.1128/MCB.01411-08. PMC 2655614. PMID 19158269.
- ↑ "Entrez Gene: CSF2 colony stimulating factor 2 (granulocyte-macrophage)".
- ↑ Armitage JO (December 1998). "Emerging applications of recombinant human granulocyte-macrophage colony-stimulating factor" (PDF). Blood. 92 (12): 4491–508. doi:10.1182/blood.V92.12.4491. PMID 9845514.
- ↑ "Molgramostim". AdisInsight. Retrieved 3 April 2018.
- ↑ Staff (May 2008). "Back to the Future: Original Liquid Leukine® Coming Soon" (PDF). Oncology Business Review. Archived from the original (PDF) on 2016-08-25. Retrieved 2016-08-29.
- ↑ Hussein AM, Ross M, Vredenburgh J, Meisenberg B, Hars V, Gilbert C, et al. (November 1995). "Effects of granulocyte-macrophage colony stimulating factor produced in Chinese hamster ovary cells (regramostim), Escherichia coli (molgramostim) and yeast (sargramostim) on priming peripheral blood progenitor cells for use with autologous bone marrow after high-dose chemotherapy". European Journal of Haematology. 55 (5): 348–56. doi:10.1111/j.1600-0609.1995.tb00713.x. PMID 7493686. S2CID 25424116.
- ↑ "Press release: Novartis Oncology sharpens focus on key growth drivers". Novartis via SEC Edgar. 30 October 2002.
- ↑ "Scientific Conclusions and Grounds for Amendment of the Summary of Product Characteristics Presented by the EMEA" (PDF). EMA CPMP. 27 June 2000.
- ↑ "Bayer Healthcare Pharmaceuticals Plant, Snohomish County, Washington State". pharmaceutical-technology.com. Retrieved 12 November 2011.
- ↑ U.S. Food & Drug Administration. "IMLYGIC (talimogene laherparepvec)". fda.gov. Retrieved 17 December 2019.
- ↑ Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N, Chesney J, et al. (September 2015). "Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma". Journal of Clinical Oncology. 33 (25): 2780–8. doi:10.1200/JCO.2014.58.3377. PMID 26014293.
- ↑ Deiß A, Brecht I, Haarmann A, Buttmann M (March 2013). "Treating multiple sclerosis with monoclonal antibodies: a 2013 update". Expert Review of Neurotherapeutics. 13 (3): 313–35. doi:10.1586/ern.13.17. PMID 23448220. S2CID 169334.
- ↑ Meisel C, Schefold JC, Pschowski R, Baumann T, Hetzger K, Gregor J, et al. (October 2009). "Granulocyte-macrophage colony-stimulating factor to reverse sepsis-associated immunosuppression: a double-blind, randomized, placebo-controlled multicenter trial". American Journal of Respiratory and Critical Care Medicine. 180 (7): 640–8. doi:10.1164/rccm.200903-0363OC. PMID 19590022.
- ↑ Pinder EM, Rostron AJ, Hellyer TP, Ruchaud-Sparagano MH, Scott J, Macfarlane JG, et al. (October 2018). "Randomised controlled trial of GM-CSF in critically ill patients with impaired neutrophil phagocytosis". Thorax. 73 (10): 918–925. doi:10.1136/thoraxjnl-2017-211323. PMC 6166597. PMID 30064991.
- ↑ 21.0 21.1 21.2 Lee KM, Achuthan AA, Hamilton JA (2020). "GM-CSF: A Promising Target in Inflammation and Autoimmunity". ImmunoTargets and Therapy. 9: 225–240. doi:10.2147/ITT.S262566. PMC 7605919. PMID 33150139.
- ↑ Thwaites RS, Sanchez Sevilla Uruchurtu A, Siggins MK, Liew F, Russell CD, Moore SC, et al. (March 2021). "Inflammatory profiles across the spectrum of disease reveal a distinct role for GM-CSF in severe COVID-19". Science Immunology. 6 (57): eabg9873. doi:10.1126/sciimmunol.abg9873. PMC 8128298. PMID 33692097.
- ↑ Zhao Y, Kilian C, Turner JE, Bosurgi L, Roedl K, Bartsch P, et al. (February 2021). "Clonal expansion and activation of tissue-resident memory-like Th17 cells expressing GM-CSF in the lungs of severe COVID-19 patients". Science Immunology. 6 (56). doi:10.1126/sciimmunol.abf6692. PMC 8128299. PMID 33622974.
बाहरी कड़ियाँ
- Official gentaur web site
- Official Leukine web site
- Granulocyte-Macrophage+Colony-Stimulating+Factor at the US National Library of Medicine Medical Subject Headings (MeSH)
- Overview of all the structural information available in the PDB for UniProt: P04141 (Granulocyte-macrophage colony-stimulating factor) at the PDBe-KB.
Template:Colony-stimulating factors Template:Cytokine receptor modulatorsश्रेणी:रक्त और रक्त बनाने वाले अंगों पर काम करने वाली दवाएंश्रेणी: विकास कारक
- Templates that generate short descriptions
- Articles with changed DrugBank identifier
- Chemicals that do not have a ChemSpider ID assigned
- Articles without EBI source
- Articles without KEGG source
- Articles without InChI source
- Articles without UNII source
- Drugs with no legal status
- Drugboxes which contain changes to verified fields
- Collapse templates
- Navigational boxes
- Navigational boxes without horizontal lists
- Sidebars with styles needing conversion
- Templates generating microformats
- Templates that are not mobile friendly
- Wikipedia metatemplates
- साइटोकिन्स
- Machine Translated Page
- Created On 10/01/2023