लुईस संरचना
लुईस संरचनाएं, जिन्हें लुईस डॉट फ़ार्मुलों, लुईस डॉट स्ट्रक्चर्स, इलेक्ट्रॉन डॉट स्ट्रक्चर्स, या लुईस इलेक्ट्रॉन डॉट स्ट्रक्चर्स (LEDS) के रूप में भी जाना जाता है, आरेख हैं जो एक अणु के परमाणुओं के साथ-साथ इलेक्ट्रॉनों के अकेले जोड़े के बीच रासायनिक बंधन दिखाते हैं। अणु में विद्यमान है।[1][2][3] किसी भी सहसंयोजक बंधित अणु के साथ-साथ जटिल (रसायन विज्ञान) के लिए एक लुईस संरचना तैयार की जा सकती है। लुईस संरचना का नाम गिल्बर्ट एन लुईस के नाम पर रखा गया था, जिन्होंने इसे अपने 1916 के लेख द एटम एंड द मॉलिक्यूल में पेश किया था।[4] लुईस संरचनाएं एक रासायनिक बंधन में साझा जोड़े का प्रतिनिधित्व करने के लिए परमाणुओं के बीच की रेखाओं को जोड़कर इलेक्ट्रॉन डॉट आरेख की अवधारणा का विस्तार करती हैं।
लुईस संरचनाएं प्रत्येक परमाणु और अणु की संरचना में उसके रासायनिक प्रतीक का उपयोग करके उसकी स्थिति को दर्शाती हैं। परमाणुओं के बीच रेखाएँ खींची जाती हैं जो एक दूसरे से जुड़ी होती हैं (रेखाओं के बजाय डॉट्स के जोड़े का उपयोग किया जा सकता है)। एकाकी जोड़े बनाने वाले अतिरिक्त इलेक्ट्रॉनों को डॉट्स के जोड़े के रूप में दर्शाया जाता है, और परमाणुओं के बगल में रखा जाता है।
हालांकि अवधि 2 तत्व और उससे आगे के मुख्य समूह तत्व आमतौर पर इलेक्ट्रॉनों को प्राप्त करने, खोने या साझा करने से प्रतिक्रिया करते हैं, जब तक कि वे (8) इलेक्ट्रॉनों, हाइड्रोजन (H) के पूर्ण ऑक्टेट नियम के साथ वैलेंस शेल इलेक्ट्रॉन कॉन्फ़िगरेशन प्राप्त नहीं कर लेते हैं, केवल बांड बना सकते हैं जो केवल दो इलेक्ट्रॉनों को साझा करें।
निर्माण और इलेक्ट्रॉन गिनती
लुईस संरचना में दर्शाए गए इलेक्ट्रॉनों की कुल संख्या प्रत्येक व्यक्तिगत परमाणु पर रासायनिक संयोजन इलेक्ट्रॉन ों की संख्या के योग के बराबर होती है। लुईस संरचनाओं में गैर-वैलेंस इलेक्ट्रॉनों का प्रतिनिधित्व नहीं किया जाता है।
एक बार उपलब्ध इलेक्ट्रॉनों की कुल संख्या निर्धारित हो जाने के बाद, इलेक्ट्रॉनों को इन चरणों के अनुसार संरचना में रखा जाना चाहिए:
- परमाणु पहले एकल बंधन से जुड़े होते हैं।
- यदि t कुल इलेक्ट्रॉनों की संख्या है और n एकल बंधों की संख्या है, तो t-2n इलेक्ट्रॉनों को रखा जाना बाकी है। इन्हें एकाकी जोड़े के रूप में रखा जाना चाहिए: उपलब्ध इलेक्ट्रॉनों के प्रत्येक जोड़े के लिए डॉट्स का एक जोड़ा। एकाकी जोड़े को शुरू में बाहरी परमाणुओं (हाइड्रोजन के अलावा) पर तब तक रखा जाना चाहिए जब तक कि प्रत्येक बाहरी परमाणु में बंधन जोड़े और एकाकी जोड़े में आठ इलेक्ट्रॉन न हों; अतिरिक्त एकाकी जोड़े को तब केंद्रीय परमाणु पर रखा जा सकता है। जब संदेह हो, तो एकाकी जोड़े को पहले अधिक विद्युतीय परमाणुओं पर रखा जाना चाहिए।
- एक बार सभी जोड़े जोड़े जाने के बाद, परमाणुओं (विशेष रूप से केंद्रीय परमाणुओं) में इलेक्ट्रॉनों का ऑक्टेट नहीं हो सकता है। इस स्थिति में, परमाणुओं को दोहरा बंधन बनाना चाहिए; दो परमाणुओं के बीच एक दूसरा बंधन बनाने के लिए इलेक्ट्रॉनों की एक अकेली जोड़ी को स्थानांतरित किया जाता है। चूंकि बंधन जोड़ी दो परमाणुओं के बीच साझा की जाती है, मूल रूप से एकमात्र जोड़ी वाले परमाणु में अभी भी एक ऑक्टेट होता है; दूसरे परमाणु के संयोजी कोश में अब दो और इलेक्ट्रॉन हैं।
पॉलीएटोमिक आयनों के लिए लुईस संरचनाएं उसी विधि से तैयार की जा सकती हैं। इलेक्ट्रॉनों की गिनती करते समय, नकारात्मक आयनों में उनके लुईस संरचनाओं में अतिरिक्त इलेक्ट्रॉनों को रखा जाना चाहिए; सकारात्मक आयनों में एक अपरिवर्तित अणु की तुलना में कम इलेक्ट्रॉन होने चाहिए। जब एक आयन की लुईस संरचना लिखी जाती है, तो पूरी संरचना को कोष्ठक में रखा जाता है, और आवेश को कोष्ठक के बाहर ऊपरी दाईं ओर एक सुपरस्क्रिप्ट के रूप में लिखा जाता है।
लुईस संरचनाओं के निर्माण के लिए एक सरल विधि प्रस्तावित की गई है, जिससे इलेक्ट्रॉनों की गिनती की आवश्यकता समाप्त हो जाती है: वैलेंस इलेक्ट्रॉनों को दिखाते हुए परमाणु खींचे जाते हैं; बॉन्ड बनाने की प्रक्रिया में शामिल परमाणुओं के वैलेंस इलेक्ट्रॉनों को जोड़कर बांड बनाए जाते हैं, और आयनों और धनायनों को उपयुक्त परमाणुओं में/से इलेक्ट्रॉनों को जोड़कर या हटाकर बनाया जाता है।[5] वैलेंस इलेक्ट्रॉनों को गिनने के लिए एक ट्रिक है, फिर ऑक्टेट नियम को पूरा करने के लिए आवश्यक इलेक्ट्रॉनों की संख्या (या हाइड्रोजन के साथ सिर्फ 2 इलेक्ट्रॉनों) की गणना करें, फिर इन दो नंबरों का अंतर लें। उत्तर उन इलेक्ट्रॉनों की संख्या है जो बांड बनाते हैं। शेष इलेक्ट्रॉन अन्य सभी परमाणुओं के अष्टक को भरने के लिए जाते हैं।
लुईस संरचनाओं और अनुनाद रूपों को लिखने के लिए एक और सरल और सामान्य प्रक्रिया प्रस्तावित की गई है।[6]
औपचारिक शुल्क
लुईस संरचनाओं के संदर्भ में, संभावित टोपोलॉजी और अनुनाद (रसायन विज्ञान) संरचनाओं के विवरण, तुलना और मूल्यांकन में औपचारिक प्रभार का उपयोग किया जाता है<ref name="miessler_1">मिस्लर, जी. एल. और टैर, डी. ए., इनऑर्गेनिक केमिस्ट्री (दूसरा संस्करण, प्रेंटिस हॉल 1998) ISBN 0-13-841891-8, पीपी. 49-53 - आंशिक शुल्क उपयोग की व्याख्या। </ रेफ> प्रत्येक परमाणु के स्पष्ट इलेक्ट्रॉनिक चार्ज का निर्धारण करके, इसकी इलेक्ट्रॉन डॉट संरचना के आधार पर, विशेष सहसंयोजकता या गैर-ध्रुवीय बंधन मानते हुए। प्रतिक्रिया तंत्र का जिक्र करते समय संभावित इलेक्ट्रॉन पुन: कॉन्फ़िगरेशन का निर्धारण करने में इसका उपयोग होता है, और अक्सर अपवादों के साथ परमाणु के आंशिक चार्ज के समान संकेत में परिणाम होता है। सामान्य तौर पर, उपयोग किए गए मार्कअप के लिए गैर-मानक परिभाषाओं को मानते हुए, परमाणु के औपचारिक प्रभार की गणना निम्न सूत्र का उपयोग करके की जा सकती है:
कहाँ:
- औपचारिक प्रभार है।
- तत्व के एक मुक्त परमाणु में वैलेंस इलेक्ट्रॉनों की संख्या का प्रतिनिधित्व करता है।
- परमाणु पर साझा न किए गए इलेक्ट्रॉनों की संख्या का प्रतिनिधित्व करता है।
- परमाणु के दूसरे के साथ बांड में इलेक्ट्रॉनों की कुल संख्या का प्रतिनिधित्व करता है।
एक परमाणु के औपचारिक आवेश की गणना वैलेंस इलेक्ट्रॉनों की संख्या के बीच के अंतर के रूप में की जाती है, जो कि एक तटस्थ परमाणु में होगा और इलेक्ट्रॉनों की संख्या जो कि लुईस संरचना में होती है। सहसंयोजक बंधों में इलेक्ट्रॉन बंध में शामिल परमाणुओं के बीच समान रूप से विभाजित होते हैं। आयन पर औपचारिक आवेशों का कुल योग आयन पर आवेश के बराबर होना चाहिए, और तटस्थ अणु पर औपचारिक आवेशों का योग शून्य के बराबर होना चाहिए।
अनुनाद
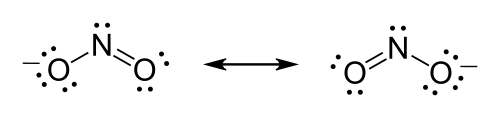
कुछ अणुओं और आयनों के लिए, यह निर्धारित करना मुश्किल है कि कौन से जोड़े को डबल या ट्रिपल बांड बनाने के लिए स्थानांतरित किया जाना चाहिए, और एक ही अणु या आयन के लिए दो या दो से अधिक भिन्न अनुनाद संरचनाएं लिखी जा सकती हैं। ऐसे मामलों में उन सभी को बीच में दो-तरफ़ा तीरों से लिखना सामान्य है (नीचे उदाहरण देखें)। यह कभी-कभी ऐसा होता है जब एक ही प्रकार के कई परमाणु केंद्रीय परमाणु को घेर लेते हैं, और विशेष रूप से बहुपरमाणुक आयनों के लिए आम है।
जब यह स्थिति होती है, अणु की लुईस संरचना को अनुनाद (रसायन विज्ञान) कहा जाता है, और अणु अनुनाद संकर के रूप में मौजूद होता है। अलग-अलग संभावनाओं में से प्रत्येक को दूसरों पर आरोपित किया जाता है, और अणु को इन अवस्थाओं के कुछ संयोजन के बराबर एक लुईस संरचना माना जाता है।
नाइट्रेट आयन (NO3−), उदाहरण के लिए, नाइट्रोजन के लिए ऑक्टेट नियम को पूरा करने के लिए नाइट्रोजन और ऑक्सीजन में से एक के बीच एक दोहरा बंधन बनाना चाहिए। हालाँकि, क्योंकि अणु सममित है, इससे कोई फर्क नहीं पड़ता कि कौन सा ऑक्सीजेन दोहरा बंधन बनाता है। इस मामले में, तीन संभावित अनुनाद संरचनाएं हैं। लुईस संरचनाओं को चित्रित करते समय अनुनाद व्यक्त करना या तो प्रत्येक संभव अनुनाद रूपों को चित्रित करके और उनके बीच दो सिरों वाले तीरों को रखकर या आंशिक बांडों का प्रतिनिधित्व करने के लिए धराशायी रेखाओं का उपयोग करके किया जा सकता है (हालांकि उत्तरार्द्ध अनुनाद संकर का एक अच्छा प्रतिनिधित्व है जो है नहीं, औपचारिक रूप से बोलना, एक लुईस संरचना)।
एक ही अणु के लिए अनुनाद संरचनाओं की तुलना करते समय, आमतौर पर सबसे कम औपचारिक शुल्क वाले समग्र अनुनाद संकर में अधिक योगदान करते हैं। जब औपचारिक आवेश आवश्यक होते हैं, तो अनुनाद संरचनाएँ जिनमें अधिक विद्युत ऋणात्मक तत्वों पर ऋणात्मक आवेश और कम विद्युत ऋणात्मक तत्वों पर धनात्मक आवेश होते हैं, को प्राथमिकता दी जाती है।
सल्फर हेक्साफ्लोराइड जैसे हाइपरवैलेंट अणुओं के लिए अनुनाद संरचनाओं को बनाने के लिए सिंगल बॉन्ड को भी उसी तरह से स्थानांतरित किया जा सकता है, जो सामान्य विस्तारित ऑक्टेट मॉडल के बजाय क्वांटम रासायनिक गणना के अनुसार सही विवरण है।
अनुनाद संरचना की व्याख्या यह इंगित करने के लिए नहीं की जानी चाहिए कि अणु रूपों के बीच स्विच करता है, लेकिन अणु कई रूपों के औसत के रूप में कार्य करता है।
उदाहरण
नाइट्राट आयन का सूत्र है NO−2.
- नाइट्रोजन दोनों में से सबसे कम विद्युतीय परमाणु है, इसलिए यह कई मानदंडों द्वारा केंद्रीय परमाणु है।
- वैलेंस इलेक्ट्रॉनों की गणना करें। नाइट्रोजन में 5 वैलेंस इलेक्ट्रॉन होते हैं; कुल (6 × 2) + 5 = 17 के लिए प्रत्येक ऑक्सीजन में 6 होते हैं। आयन में -1 का आवेश होता है, जो एक अतिरिक्त इलेक्ट्रॉन को इंगित करता है, इसलिए इलेक्ट्रॉनों की कुल संख्या 18 है।
- परमाणुओं को सिंगल बॉन्ड से कनेक्ट करें। प्रत्येक ऑक्सीजन को नाइट्रोजन से बंधित होना चाहिए, जो चार इलेक्ट्रॉनों का उपयोग करता है - प्रत्येक बंधन में दो।
- अकेले जोड़े रखें। शेष 14 इलेक्ट्रॉनों को प्रारंभ में 7 एकाकी जोड़े के रूप में रखा जाना चाहिए। प्रत्येक ऑक्सीजन अधिकतम 3 अकेला जोड़े ले सकता है, जिससे प्रत्येक ऑक्सीजन 8 इलेक्ट्रॉनों को बंधन जोड़ी सहित दे सकता है। सातवां अकेला जोड़ा नाइट्रोजन परमाणु पर रखा जाना चाहिए।
- ऑक्टेट नियम को संतुष्ट करें। दोनों ऑक्सीजन परमाणुओं में वर्तमान में 8 इलेक्ट्रॉनों को सौंपा गया है। नाइट्रोजन परमाणु को केवल 6 इलेक्ट्रॉनों को सौंपा गया है। ऑक्सीजन परमाणु पर एकाकी जोड़े में से एक को दोहरा बंधन बनाना चाहिए, लेकिन कोई भी परमाणु समान रूप से अच्छी तरह से काम करेगा। इसलिए, एक अनुनाद संरचना है।
- अधूरा अंश बांधना। दो लुईस संरचनाएं खींची जानी चाहिए: प्रत्येक संरचना में दो ऑक्सीजन परमाणुओं में से एक नाइट्रोजन परमाणु के साथ डबल-बंधित होता है। प्रत्येक संरचना में दूसरा ऑक्सीजन परमाणु नाइट्रोजन परमाणु से एकल-बंधित होगा। प्रत्येक संरचना के चारों ओर कोष्ठक रखें, और कोष्ठक के बाहर ऊपरी दाएँ भाग में आवेश (-) जोड़ें। दो अनुनाद रूपों के बीच एक दो सिरों वाला तीर बनाएं।
वैकल्पिक रूप
रासायनिक संरचनाओं को अधिक सघन रूपों में लिखा जा सकता है, खासकर जब कार्बनिक यौगिक दिखा रहे हों। संघनित संरचनात्मक सूत्रों में, कई या यहां तक कि सभी सहसंयोजक बंधों को छोड़ दिया जा सकता है, सबस्क्रिप्ट के साथ एक विशेष परमाणु से जुड़े समान समूहों की संख्या का संकेत मिलता है।
एक अन्य आशुलिपि संरचनात्मक आरेख कंकाल सूत्र है (जिसे बंधन-रेखा सूत्र या कार्बन कंकाल आरेख के रूप में भी जाना जाता है)। एक कंकाल सूत्र में, कार्बन परमाणुओं को प्रतीक सी द्वारा नहीं बल्कि रेखाओं के शीर्ष (ग्राफ सिद्धांत) द्वारा दर्शाया जाता है। कार्बन से बंधे हाइड्रोजन परमाणुओं को नहीं दिखाया जाता है - उन्हें एक विशेष कार्बन परमाणु के लिए बांड की संख्या की गणना करके अनुमान लगाया जा सकता है - प्रत्येक कार्बन को कुल चार बांड माना जाता है, इसलिए किसी भी बंधन को नहीं दिखाया जाता है, निहितार्थ से, हाइड्रोजन परमाणुओं के लिए।
अन्य आरेख लुईस संरचनाओं की तुलना में अधिक जटिल हो सकते हैं, जो अंतरिक्ष-भरने वाले आरेखों जैसे विभिन्न रूपों का उपयोग करके 3डी में बांड दिखाते हैं।
उपयोग और सीमाएं
बीसवीं शताब्दी की शुरुआत में उनकी सादगी और विकास के बावजूद, जब रासायनिक बंधन की समझ अभी भी अल्पविकसित थी, लुईस संरचनाएं आणविक प्रणालियों की एक श्रृंखला की इलेक्ट्रॉनिक संरचना की कई प्रमुख विशेषताओं को पकड़ती हैं, जिनमें रासायनिक प्रतिक्रियाशीलता की प्रासंगिकता भी शामिल है। इस प्रकार, वे रसायनज्ञों और रसायन विज्ञान के शिक्षकों द्वारा व्यापक उपयोग का आनंद लेना जारी रखते हैं। यह कार्बनिक रसायन विज्ञान के क्षेत्र में विशेष रूप से सच है, जहां बंधन का पारंपरिक वैलेंस-बॉन्ड मॉडल अभी भी हावी है, और तंत्र को अक्सर तीर धकेलना के संदर्भ में समझा जाता है। कर्व-एरो नोटेशन स्केलेटल फॉर्मूले पर आरोपित है, जो लुईस संरचनाओं के शॉर्टहैंड संस्करण हैं। . अकार्बनिक रसायन विज्ञान और ऑर्गेनोमेटेलिक रसायन विज्ञान में मिलने वाली बंधन योजनाओं की अधिक विविधता के कारण, अणुओं में से कई को अपने बंधन का पर्याप्त रूप से वर्णन करने के लिए पूरी तरह से डेलोकलाइज्ड आणविक कक्षीय के उपयोग की आवश्यकता होती है, जिससे लुईस संरचनाएं तुलनात्मक रूप से कम महत्वपूर्ण हो जाती हैं (हालांकि वे अभी भी सामान्य हैं)।
यह नोट करना महत्वपूर्ण है कि सरल और मूलरूपी आणविक प्रणालियां हैं जिनके लिए एक लुईस विवरण, कम से कम असंशोधित रूप में, भ्रामक या गलत है। विशेष रूप से, अयुग्मित इलेक्ट्रॉनों (जैसे, O2, नहीं, और क्लो2) बॉन्ड ऑर्डर, बॉन्ड लम्बाई, और/या चुंबकीय गुणों के गलत अनुमानों की ओर जाता है। एक साधारण लुईस मॉडल भी सुगन्धितता की घटना के लिए जिम्मेदार नहीं है। उदाहरण के लिए, लुईस संरचनाएं चक्रीय सी के लिए स्पष्टीकरण प्रदान नहीं करती हैं6H6 (बेंजीन) सामान्य निरूपण प्रभावों से परे विशेष स्थिरीकरण का अनुभव करता है, जबकि सी4H4 (Cyclobutadiene) वास्तव में एक विशेष अस्थिरता का अनुभव करता है। आणविक कक्षीय सिद्धांत इन घटनाओं के लिए सबसे सरल व्याख्या प्रदान करता है।
यह भी देखें
संदर्भ
- ↑ IUPAC definition of Lewis formula
- ↑ Zumdahl, S. (2005) Chemical Principles Houghton-Mifflin (ISBN 0-618-37206-7)
- ↑ G.L. Miessler; D.A. Tarr (2003), Inorganic Chemistry (2nd ed.), Pearson Prentice–Hall, ISBN 0-13-035471-6
- ↑ Lewis, G. N. (1916), "The Atom and the Molecule", J. Am. Chem. Soc., 38 (4): 762–85, doi:10.1021/ja02261a002, S2CID 95865413
- ↑ Miburo, Barnabe B. (1993), "Simplified Lewis Structure Drawing for Non-science Majors", J. Chem. Educ., 75 (3): 317, Bibcode:1998JChEd..75..317M, doi:10.1021/ed075p317
- ↑ Lever, A. B. P. (1972), "Lewis Structures and the Octet Rule", J. Chem. Educ., 49 (12): 819, Bibcode:1972JChEd..49..819L, doi:10.1021/ed049p819
बाहरी संबंध
- Templates that generate short descriptions
- Collapse templates
- Navigational boxes
- Navigational boxes without horizontal lists
- Sidebars with styles needing conversion
- Templates generating microformats
- Templates that are not mobile friendly
- Wikipedia metatemplates
- 1916 परिचय
- रासायनिक सूत्र
- रासायनिक संबंध
- Machine Translated Page
- Created On 16/05/2023