विशिष्ट गर्मी की क्षमता
ऊष्मप्रवैगिकी में, विशिष्ट ताप क्षमता (प्रतीक c) किसी पदार्थ के नमूने के द्रव्यमान द्वारा विभाजित पदार्थ के नमूने की ताप क्षमता है, जिसे कभी-कभी सामूहिक ताप क्षमता भी कहा जाता है। अनौपचारिक रूप से, यह ऊष्मा की वह मात्रा है जिसे किसी पदार्थ के द्रव्यमान की एक इकाई में जोड़ा जाना चाहिए ताकि तापमान में एक इकाई की वृद्धि हो सके। विशिष्ट ताप क्षमता की इकाइयों की अंतर्राष्ट्रीय प्रणाली जूल प्रति केल्विन प्रति किलोग्राम, J⋅kg है−1⋅K-1.[1] उदाहरण के लिए, तापमान बढ़ाने के लिए आवश्यक ऊष्मा 1 kg पानी द्वारा 1 K है 4184 joules, इसलिए पानी की विशिष्ट ऊष्मा क्षमता है 4184 J⋅kg−1⋅K−1.[2] विशिष्ट ताप क्षमता अक्सर तापमान के साथ बदलती रहती है, और पदार्थ की प्रत्येक अवस्था के लिए भिन्न होती है। तरल पानी में सामान्य पदार्थों के बीच सबसे अधिक विशिष्ट ऊष्मा क्षमता होती है 4184 J⋅kg−1⋅K−1 20 डिग्री सेल्सियस पर; लेकिन वह बर्फ का, जो 0 °C से ठीक नीचे है, केवल है 2093 J⋅kg−1⋅K−1. लोहा, ग्रेनाइट, और हाइड्रोजन गैस की विशिष्ट ताप क्षमता लगभग 449 J⋅kg है−1⋅K−1, 790 J⋅किग्रा−1⋅K−1, और 14300 J⋅kg−1⋅K-1, क्रमशः।[3] जबकि पदार्थ एक चरण संक्रमण से गुजर रहा है, जैसे कि पिघलना या उबलना, इसकी विशिष्ट ताप क्षमता तकनीकी रूप से अपरिभाषित है, क्योंकि ताप अपना तापमान बढ़ाने के बजाय अपनी स्थिति को बदलने में चला जाता है।
किसी पदार्थ की विशिष्ट ताप क्षमता, विशेष रूप से एक गैस, जब विस्तार करने की अनुमति दी जाती है तो यह काफी अधिक हो सकती है क्योंकि इसे गर्म किया जाता है (स्थिर दबाव पर विशिष्ट ताप क्षमता) जब इसे एक बंद बर्तन में गर्म किया जाता है जो विस्तार को रोकता है (विशिष्ट ताप क्षमता) स्थिर मात्रा में)। इन दो मूल्यों को आमतौर पर द्वारा निरूपित किया जाता है और , क्रमश; उनका भागफल ताप क्षमता अनुपात है।
विशिष्ट ताप शब्द किसी दिए गए तापमान पर किसी पदार्थ की विशिष्ट ताप क्षमता और संदर्भ तापमान पर किसी संदर्भ पदार्थ के बीच के अनुपात को भी संदर्भित कर सकता है, जैसे कि 15 डिग्री सेल्सियस पर पानी;[4] विशिष्ट गुरुत्व के फैशन में ज्यादा। विशिष्ट ताप क्षमता अन्य भाजक के साथ ताप क्षमता के अन्य गहन उपायों से भी संबंधित है। यदि पदार्थ की मात्रा को तिल (इकाई) की संख्या के रूप में मापा जाता है, तो इसके बजाय मोलर ताप क्षमता प्राप्त होती है, जिसका SI मात्रक जूल प्रति केल्विन प्रति मोल, J⋅mol है−1⋅K-1. यदि राशि को नमूने की मात्रा के रूप में लिया जाता है (जैसा कि कभी-कभी इंजीनियरिंग में किया जाता है), तो एक को आयतन ेट्रिक ताप क्षमता प्राप्त होती है, जिसका SI मात्रक जूल प्रति केल्विन प्रति घन मीटर, J⋅m है−3⋅K-1.
अवधारणा का उपयोग करने वाले पहले वैज्ञानिकों में से एक जोसेफ ब्लैक, 18 वीं शताब्दी के मेडिकल डॉक्टर और ग्लासगो विश्वविद्यालय में मेडिसिन के प्रोफेसर थे। उन्होंने गर्मी के लिए शब्द क्षमता का उपयोग करते हुए, कई पदार्थों की विशिष्ट ताप क्षमता को मापा।[5]
परिभाषा
किसी पदार्थ की विशिष्ट ऊष्मा क्षमता, जिसे आमतौर पर निरूपित किया जाता है या s, ताप क्षमता है द्रव्यमान द्वारा विभाजित पदार्थ का एक नमूना नमूने का:[6]
कहाँ एक छोटे से वेतन वृद्धि द्वारा नमूने के तापमान को समान रूप से बढ़ाने के लिए आवश्यक ऊष्मा की मात्रा को व्युत्पन्न करें .
किसी वस्तु की ताप क्षमता की तरह, किसी पदार्थ की विशिष्ट ऊष्मा क्षमता भिन्न हो सकती है, कभी-कभी प्रारंभिक तापमान के आधार पर काफी हद तक नमूना और दबाव उस पर आवेदन किया। इसलिए, इसे एक कार्य माना जाना चाहिए उन दो चरों में से।
किसी पदार्थ की विशिष्ट ताप क्षमता देते समय ये पैरामीटर आमतौर पर निर्दिष्ट होते हैं। उदाहरण के लिए, पानी (तरल): = 4187 J⋅kg−1⋅K-1 (15°C) [7] निर्दिष्ट नहीं होने पर, विशिष्ट ताप क्षमता के प्रकाशित मूल्य आमतौर पर तापमान और दबाव के लिए कुछ मानक स्थितियों के लिए मान्य होते हैं।
हालाँकि, की निर्भरता प्रारंभिक तापमान और दबाव को अक्सर व्यावहारिक संदर्भों में अनदेखा किया जा सकता है, उदा। उन चरों की संकीर्ण श्रेणियों में काम करते समय। उन संदर्भों में आमतौर पर क्वालीफायर को छोड़ दिया जाता है , और एक स्थिर द्वारा विशिष्ट ताप क्षमता का अनुमान लगाता है उन श्रेणियों के लिए उपयुक्त।
विशिष्ट ताप क्षमता पदार्थ की एक गहन संपत्ति है, एक आंतरिक विशेषता है जो विचाराधीन राशि के आकार या आकार पर निर्भर नहीं करती है। (एक व्यापक संपत्ति के सामने विशिष्ट क्वालीफायर अक्सर इससे प्राप्त एक गहन संपत्ति को इंगित करता है।[8])
विविधताएं
किसी पदार्थ में उष्मा ऊर्जा का अंतःक्षेपण, इसके तापमान को बढ़ाने के अलावा, आमतौर पर इसकी मात्रा और/या इसके दबाव में वृद्धि का कारण बनता है, यह इस बात पर निर्भर करता है कि नमूना कैसे सीमित है। उत्तरार्द्ध के बारे में की गई पसंद मापी गई विशिष्ट ताप क्षमता को प्रभावित करती है, यहां तक कि समान शुरुआती दबाव के लिए भी और शुरुआती तापमान . दो विशेष विकल्प व्यापक रूप से उपयोग किए जाते हैं:
- यदि दबाव स्थिर रखा जाता है (उदाहरण के लिए, परिवेशी वायुमंडलीय दबाव पर), और नमूने को विस्तार करने की अनुमति दी जाती है, तो विस्तार कार्य (थर्मोडायनामिक्स) उत्पन्न करता है क्योंकि दबाव से बल बाड़े या आसपास के द्रव को विस्थापित करता है। वह काम प्रदान की गई ऊष्मा ऊर्जा से आना चाहिए। इस प्रकार प्राप्त विशिष्ट ताप क्षमता को निरंतर दबाव (या आइसोबैरिक) पर मापा जाता है, और इसे अक्सर निरूपित किया जाता है , , वगैरह।
- दूसरी ओर, यदि विस्तार को रोका जाता है - उदाहरण के लिए एक पर्याप्त रूप से कठोर बाड़े द्वारा, या आंतरिक एक का प्रतिकार करने के लिए बाहरी दबाव बढ़ाकर - कोई कार्य उत्पन्न नहीं होता है, और इसमें जाने वाली ऊष्मा ऊर्जा को इसके बजाय योगदान देना चाहिए नमूने की आंतरिक ऊर्जा के लिए, इसके तापमान को अतिरिक्त मात्रा में बढ़ाने सहित। इस तरह से प्राप्त विशिष्ट ताप क्षमता को स्थिर आयतन (या आइसोकोरिक) पर मापा जाता है और निरूपित किया जाता है , , , वगैरह।
का मान है के मान से प्रायः कम होता है . यह अंतर गैसों में विशेष रूप से उल्लेखनीय है जहां निरंतर दबाव के तहत मूल्य स्थिर मात्रा में 30% से 66.7% अधिक होता है। इसलिए गैसों का ताप क्षमता अनुपात आमतौर पर 1.3 और 1.67 के बीच होता है।[9]
प्रयोज्यता
विशिष्ट ताप क्षमता को काफी सामान्य संरचना और आणविक संरचना के गैसों, तरल और ठोस के लिए परिभाषित और मापा जा सकता है। यदि पर्याप्त रूप से बड़े पैमाने पर विचार किया जाए तो इनमें गैस मिश्रण, समाधान और मिश्र धातु, या विषम सामग्री जैसे दूध, रेत, ग्रेनाइट और कंक्रीट शामिल हैं।
विशिष्ट ताप क्षमता को उन सामग्रियों के लिए भी परिभाषित किया जा सकता है जो स्थिति या संरचना को तापमान और दबाव में परिवर्तन के रूप में बदलते हैं, जब तक परिवर्तन प्रतिवर्ती और क्रमिक होते हैं। इस प्रकार, उदाहरण के लिए, अवधारणाओं को एक गैस या तरल के लिए परिभाषित किया जा सकता है जो तापमान बढ़ने पर अलग हो जाता है, जब तक कि पृथक्करण के उत्पाद तुरंत और पूरी तरह से पुन: संयोजित हो जाते हैं जब यह गिरता है।
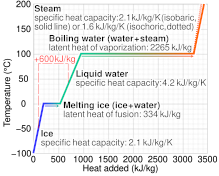
विशिष्ट ताप क्षमता अर्थपूर्ण नहीं है यदि पदार्थ अपरिवर्तनीय रासायनिक परिवर्तनों से गुजरता है, या यदि कोई चरण संक्रमण होता है, जैसे पिघलने या उबलते हुए, माप द्वारा फैले तापमान की सीमा के भीतर तेज तापमान पर।
नाप
किसी पदार्थ की विशिष्ट ऊष्मा क्षमता आमतौर पर परिभाषा के अनुसार निर्धारित की जाती है; अर्थात्, आमतौर पर एक कैलोरीमीटर के साथ पदार्थ के एक नमूने की ताप क्षमता को मापकर, और नमूने के द्रव्यमान से विभाजित करके। किसी पदार्थ की ऊष्मा क्षमता का अनुमान लगाने के लिए कई तकनीकों को लागू किया जा सकता है, जैसे कि तेज़ अंतर स्कैनिंग कैलोरीमेट्री।[10][11]
एक कठोर कंटेनर में नमूना संलग्न करके, गैसों की विशिष्ट ताप क्षमता को निरंतर मात्रा में मापा जा सकता है। दूसरी ओर, स्थिर आयतन पर विशिष्ट ऊष्मा क्षमता को मापना तरल और ठोस पदार्थों के लिए निषेधात्मक रूप से कठिन हो सकता है, क्योंकि तापमान में मामूली वृद्धि के कारण होने वाले विस्तार को रोकने के लिए अक्सर अव्यावहारिक दबावों की आवश्यकता होती है। इसके बजाय, सामान्य अभ्यास निरंतर दबाव पर विशिष्ट ताप क्षमता को मापना है (सामग्री को अपनी इच्छा के अनुसार विस्तार या अनुबंध करने की अनुमति देना), थर्मल विस्तार के गुणांक और सामग्री के थोक मापांक को अलग से निर्धारित करना और विशिष्ट ताप क्षमता की गणना करना ऊष्मप्रवैगिकी के नियमों के अनुसार इन आंकड़ों से निरंतर आयतन।[citation needed]
पहले सिद्धांतों से गणना
पाथ इंटीग्रल मोंटे कार्लो विधि क्वांटम डायनेमिक सिद्धांतों के आधार पर ऊष्मा क्षमता के मूल्यों को निर्धारित करने के लिए एक संख्यात्मक दृष्टिकोण है। हालांकि, नीचे उल्लिखित सरल विधियों का उपयोग करके कई राज्यों में गैसों के लिए अच्छा अनुमान लगाया जा सकता है। गैर-क्रायोजेनिक तापमान पर अपेक्षाकृत भारी परमाणुओं (परमाणु संख्या> लोहा) से बने कई ठोस पदार्थों के लिए, कमरे के तापमान पर ताप क्षमता 3R = 24.94 जूल प्रति केल्विन प्रति मोल परमाणु (डुलोंग-पेटिट नियम, R गैस स्थिरांक है) तक पहुंचती है। . गैसों और ठोसों दोनों के लिए कम तापमान सन्निकटन उनके विशिष्ट आइंस्टीन तापमान या डेबी तापमान से कम तापमान पर आइंस्टीन और डेबी के नीचे चर्चा की गई विधियों द्वारा किया जा सकता है। हालांकि, विचारित सामग्री के लिए राज्य के समीकरण के साथ उपयोग किए जाने पर इस तरह के प्रारंभिक विचारों की स्थिरता के लिए ध्यान दिया जाना चाहिए।[12]
आदर्श गैस
एक आदर्श गैस के लिए, राज्य के समीकरण के अनुसार उपरोक्त आंशिक डेरिवेटिव का मूल्यांकन करना, जहां R एक आदर्श गैस के लिए गैस स्थिरांक है[13]
स्थानापन्न
यह समीकरण केवल जूलियस रॉबर्ट वॉन मेयर के संबंध को कम करता है:
उपरोक्त मेयर संबंध द्वारा परिभाषित ताप क्षमता में अंतर केवल एक आदर्श गैस के लिए सटीक है और किसी भी वास्तविक गैस के लिए अलग होगा।
यह भी देखें
- संलयन की तापीय धारिता (संलयन की तापीय धारिता)
- वाष्पीकरण की तापीय धारिता (वाष्पीकरण की तापीय धारिता)
- फ्रेनकेल लाइन
- ताप क्षमता अनुपात
- ऊष्मा समीकरण
- गर्मी हस्तांतरण गुणांक
- ऊष्मप्रवैगिकी का इतिहास
- जॉबबैक विधि (ताप क्षमता का अनुमान)
- अव्यक्त गर्मी
- भौतिक गुण (थर्मोडायनामिक्स)
- क्वांटम सांख्यिकीय यांत्रिकी
- आर-मूल्य (इन्सुलेशन)
- वाष्पीकरण की तापीय धारिता
- संलयन की तापीय धारिता
- सांख्यिकीय यांत्रिकी
- विशिष्ट ताप क्षमता की तालिका
- थर्मल द्रव्यमान
- शुद्ध पदार्थों के लिए थर्मोडायनामिक डेटाबेस
- थर्मोडायनामिक समीकरण
- वॉल्यूमेट्रिक ताप क्षमता
टिप्पणियाँ
संदर्भ
- ↑ Open University (2008). S104 Book 3 Energy and Light, p. 59. The Open University. ISBN 9781848731646.
- ↑ Open University (2008). S104 Book 3 Energy and Light, p. 179. The Open University. ISBN 9781848731646.
- ↑ Engineering ToolBox (2003). "कुछ सामान्य पदार्थों की विशिष्ट ऊष्मा".
- ↑ (2001): Columbia Encyclopedia, 6th ed.; as quoted by Encyclopedia.com. Columbia University Press. Accessed on 2019-04-11.
- ↑ Laidler, Keith, J. (1993). The World of Physical Chemistry. Oxford University Press. ISBN 0-19-855919-4.
- ↑ International Bureau of Weights and Measures (2006), The International System of Units (SI) (PDF) (8th ed.), ISBN 92-822-2213-6, archived (PDF) from the original on 2021-06-04, retrieved 2021-12-16
- ↑ "Water – Thermal Properties". Engineeringtoolbox.com. Retrieved 2021-03-29.
- ↑ International Union of Pure and Applied Chemistry, Physical Chemistry Division. "भौतिक रसायन विज्ञान में मात्राएँ, इकाइयाँ और प्रतीक" (PDF). Blackwell Sciences. p. 7.
The adjective specific before the name of an extensive quantity is often used to mean divided by mass.
- ↑ Lange's Handbook of Chemistry, 10th ed. page 1524
- ↑ Quick, C. R.; Schawe, J. E. K.; Uggowitzer, P. J.; Pogatscher, S. (2019-07-01). "Measurement of specific heat capacity via fast scanning calorimetry—Accuracy and loss corrections". Thermochimica Acta. Special Issue on occasion of the 65th birthday of Christoph Schick. 677: 12–20. doi:10.1016/j.tca.2019.03.021. ISSN 0040-6031.
- ↑ Pogatscher, S.; Leutenegger, D.; Schawe, J. E. K.; Uggowitzer, P. J.; Löffler, J. F. (September 2016). "Solid–solid phase transitions via melting in metals". Nature Communications. 7 (1): 11113. Bibcode:2016NatCo...711113P. doi:10.1038/ncomms11113. ISSN 2041-1723. PMC 4844691. PMID 27103085.
- ↑ S. Benjelloun, "Thermodynamic identities and thermodynamic consistency of Equation of States", Link to Archiv e-print Link to Hal e-print
- ↑ Cengel, Yunus A. and Boles, Michael A. (2010) Thermodynamics: An Engineering Approach, 7th Edition, McGraw-Hill ISBN 007-352932-X.
अग्रिम पठन
- Emmerich Wilhelm & Trevor M. Letcher, Eds., 2010, Heat Capacities: Liquids, Solutions and Vapours, Cambridge, U.K.:Royal Society of Chemistry, ISBN 0-85404-176-1. A very recent outline of selected traditional aspects of the title subject, including a recent specialist introduction to its theory, Emmerich Wilhelm, "Heat Capacities: Introduction, Concepts, and Selected Applications" (Chapter 1, pp. 1–27), chapters on traditional and more contemporary experimental methods such as photoacoustic methods, e.g., Jan Thoen & Christ Glorieux, "Photothermal Techniques for Heat Capacities," and chapters on newer research interests, including on the heat capacities of proteins and other polymeric systems (Chs. 16, 15), of liquid crystals (Ch. 17), etc.